
��һ��ɫ������Һ��Ҫȷ���Ƿ����������ӣ�K����Mg2����Al3����Fe2����Ba2����NO3����SO42����Cl����I����HCO3����ȡ����Һʵ�����£�
| ʵ�鲽�� | ʵ������ |
| ��1��ȡ��������Һ���Ӽ��μ��� | ��Һ���ɫ |
| ��2��ȡ��������Һ����Ũ������CuƬ��ŨH2SO4������ | ����ɫ����������������������Ա�ɺ���ɫ |
| ��3��ȡ��������Һ����BaCl2��Һ | �а�ɫ�������� |
| ��4��ȡ��3�����ϲ���Һ����AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����HNO3 |
| ��5��ȡ��������Һ����NaOH��Һ | �а�ɫ�������ɣ���NaOH����ʱ���������ܽ� |
��1��Al3����Mg2����NO3����SO42����Fe2����Ba2����I����HCO3��
��2����ɫ��Ӧ������K����ϡHNO3��Һ��AgNO3��Һ������Cl����
���������������1�����и�����ɫ��������������Fe2������1��˵����ҺΪ���ԣ�������HCO3-����2�����ж�����Һ�д���NO3-����Ϊ���ԣ�I-�����ܴ��ڣ���3����BaCl2��Һ�а�ɫ�������ɣ����жϳ���SO42��������Ba2������4�������ж���Cl������3��������Cl������5����NaOH��Һ���а�ɫ�������ɣ���NaOH����ʱ���������ܽ⣬˵������Mg2����Al3����ֻ��K����Cl�����������жϡ�
��2������һ��ȷ���Ƿ���K+��Cl?����ͨ����ɫ��Ӧ����K+������ϡHNO3��Һ��AgNO3��Һ���ɼ���Cl-��
���㣺���⿼�����ӵ��ƶϡ����Ӽ��顣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��.���Ρ���������ʵ���ҳ��õ�ҩƷ��
��������⣬���������գ�
(1)���ữ��FeCl3��Һ����μ���KI��Һ����Һ����غ�ɫ���÷�Ӧ�����ӷ���ʽΪ________________��
(2)���ữ��FeSO4��Һ�мӼ������軯����Һ��û��ʲô���Ա仯���ٵμ�˫��ˮ����Һ��Ѫ��ɫ�������μ�˫��ˮ��Ѫ��ɫ����ȥ���������ݲ�����
д�������仯�У��йط�Ӧ�����ӷ���ʽ��
��____________________________________��
��Fe3����3SCN��=Fe(SCN)3��
��11H2O2��2SCN��=2SO42����2CO2����N2����10H2O��2H��
������1 mol N2��H2O2��SCN���ķ�Ӧ��ת�Ƶ��ӵ����ʵ�����________ mol��
(3)��������ʵ�飬�ƶ�Fe2����I����SCN���Ļ�ԭ����ǿ������˳��Ϊ________��
��.ij����������Fe�ۺ�KNO3��Һ��Ӧ��ģ�����ˮ�ѵ����̣�̽���ѵ�ԭ����
(4)ʵ��ǰ��������0.1 mol��L��1 H2SO4ϴ��Fe�ۣ���Ŀ����__________��Ȼ��������ˮϴ�������ԣ��ڽ�KNO3��Һ��pH����2.5����Ϊ��ֹ�����е�O2���ѵ���Ӱ�죬Ӧ��KNO3��Һͨ��________(д��ѧʽ)��
(5)��ͼ��ʾ����Fe�ۻ�ԭ����KNO3��Һ�����У��������Һ���������Ũ�ȡ�pH��ʱ��ı仯��ϵ(���ָ���Ӧ����������ȥ)�������ͼ����Ϣд��t1ʱ��ǰ�÷�Ӧ���ɵ������ӷֱ���________��________��t1ʱ�̺÷�Ӧ���ڽ��У���Һ��NH4+��Ũ��������Fe2����Ũ��ȴû�������ܵ�ԭ����__________________��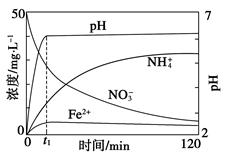
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ȣ�ClO2����һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������������Cl2��Ȳ��������������DZ��Σ�����л��ȴ���Ʊ�ClO2���������ַ�����
����һ��2 NaClO3 + 4 HCl��2 ClO2��+ Cl2��+ 2 NaCl + 2 H2O
��������2 NaClO3 + H2O2 + H2SO4��2 ClO2��+ O2��+2 Na2SO4 + 2 H2O
��1������һ�����ӷ���ʽΪ ��
��2���������б������������� ������Ӧ����0.1mol����ת�ƣ��������ClO2�����ڱ�״���µ����Ϊ L��
��3���뷽��һ�Ƚϣ��÷������Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ճ�����ˮ��NO3һ�ĺ�����ˮ�������������Ҫ��֮һ���ﵽһ��Ũ��ʱ������ཡ������Σ����Ϊ�˽�������ˮ��NO3һ��Ũ�ȣ�ij��ȤС��������·�����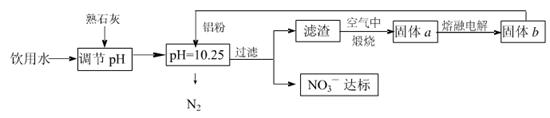
��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�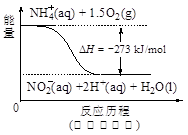

��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Ҫ��д�����з���ʽ��
��1��������Ͷ��FeCl3��Һ�з�Ӧ�������ӷ���ʽ ��
��2����������Ͷ������ͭ��Һ�������ӷ���ʽ ��
��3��̼���Ⱶ�������������Ʒ�Ӧ�����ӻ�ѧ����ʽ ��
��4��������̼�����Ʒ�Ӧ�����ӷ���ʽ_____________________________________________��
��5��������������������Һ��Ӧ�����ӷ���ʽ_______________________________________��
��6����NaHSO4��Һ��������������Һ�����ԣ�������Ӧ�����Һ�е����������������ӷ���ʽ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��.��4�֣�ʵ������һƿ�������Һ��ʵ����Աȷ�����п��ܺ���NH4+��K+��Na+��Mg2+��Ba2+��Al3+��Fe3+��Cl-��I-��NO3-��CO32-��SO42-��ȡ����Һ��������ʵ�飺
��ȡpH��ֽ���飬������Һ��ǿ���ԡ�
��ȡ��������Һ����������CCl4������������ˮ������CCl4����Ϻ�ɫ��
����ȡ������Һ����NaOH��Һ��ʹ��Һ��������Ϊ���ԣ��ڵμӹ����к͵μ���Ϻ���Һ������������
��ȡ��������������Һ��Na2CO3��Һ���а�ɫ�������ɡ�
�ݽ��۵õ��ļ�����Һ���ȣ�������ų�����������ʹʪ��ĺ�ɫʯ����ֽ������
����ڵ�ˮ���м���HNO3�ữ��AgNO3��Һ�а�ɫ������
��������ʵ����ʵȷ���������жϸ���Һ��
��1���϶����ڵ������� ��
��2������ȷ���Ƿ���ڵ������� ��
��. ��6�֣���������(SeO2)��һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��ŨH2SO4��Ӧ����SeO2�Ի���Se�����������գ�
��1��Se��ŨHNO3��Ӧ�Ļ�ԭ����ΪNO��NO2����NO��NO2�����ʵ���֮��Ϊ1��1��д��Se��ŨHNO3�ķ�Ӧ����ʽ ��
��2����֪��Se+2H2SO4(Ũ)��2SO2��+SeO2+2H2O��2SO2+SeO2+2H2O��Se+2SO42-+4H+
SeO2��H2SO4(Ũ)��SO2����������ǿ������˳���� ��
��3�����յõ���SeO2�ĺ���������ͨ������ķ����ⶨ��
��SeO2+ 4KI+ 4HNO3��Se+2I2+ 4KNO3+2H2O ��I2+2Na2S2O3��Na2S4O6+2NaI
ʵ���У�ȷ����SeO2��Ʒ0.1500g��������0.2000 mol/L��Na2S2O3��Һ25.00 mL�����ⶨ����Ʒ��SeO2����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Ҫ��ȷ�������б仯�����еĻ�ѧ������У�1��~��3��д��ѧ����ʽ����4��~��5��д���ӷ���ʽ��
��1����˿��������ȼ�� �� ��2��������SO2������ ��
��3��þ�ڶ�����̼��ȼ�� ����4��NaOH��Һ��NaHCO3��Һ��Ӧ ��
��5�����Ȼ�����Һ�̻���·�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�裨CN��2�����裨SCN��2�Ļ�ѧ���ʺ�±�غ����ƣ���ѧ�ϳ�Ϊ����±�ء������������ӵĻ�ԭ��ǿ��Ϊ��Cl����Br����CN����SCN����I����
�����
��1����CN��2��KOH��aq����Ӧ�Ļ�ѧ����ʽ���� ����
��2��NaBr��KSCN�Ļ����Һ�м���������CN��2��Ӧ�����ӷ���ʽ���� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)(4��)д������������ˮ��Һ�еĵ��뷽��ʽ��
HNO3 Ba(OH)2
NaHCO3 NaHSO4
(2)(4��)��ʵ�����Ʊ������Ĺ����У����������ͨ����������������Һ�������գ���д���˷�Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ��
�û�ѧ��Ӧ�У��������� ����ԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com