
(1)(4分)写出下列物质在水溶液中的电离方程式:
HNO3 Ba(OH)2
NaHCO3 NaHSO4
(2)(4分)在实验室制备氯气的过程中,多余的氯气通常是用氢氧化钠溶液进行吸收,请写出此反应的化学方程式并标出电子转移的方向和数目。
该化学反应中,氧化剂是 ,还原剂是 。
(1)(4分) HNO3=H++NO3– Ba(OH)2=Ba2++2OH–
NaHCO3=Na++HCO3– NaHSO4=Na++H++SO42–
(2)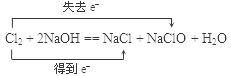 Cl2 Cl2
Cl2 Cl2
解析试题分析:(1)酸能电离出H+和酸根离子,故HNO3电离方程式为:HNO3=H++NO3–;碱电离出金属离子和OH–,故Ba(OH)2电离方程式为:Ba(OH)2=Ba2++2OH–;弱酸的酸式盐电离时产生的是金属离子和酸式酸根离子,故NaHCO3电离方程式为:NaHCO3=Na++HCO3–;强酸的酸式盐能完全电离出H+,故NaHSO4电离方程式为:NaHSO4=Na++H++SO42–。
(2)在氯气跟氢氧化钠溶液的反应中,氯元素的化合价既降低(由0价降到–1价)又升高(由0价升到+1价),所以氯气既是氧化剂又是还原剂。
考点:考查电离方程式的书写、氧化还原反应的表示方法及氧化剂和还原剂的判断。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
有一无色透明的溶液,要确定是否含有以下离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)根据化学方程式,写出对应的离子方程式:
①AgNO3+KCl=AgCl↓+KNO3
②CuO+H2SO4=CuSO4+H2O
(2)写出一个能实现下列离子反应的化学方程式:
①Fe+Cu2+=Fe2++Cu
②CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO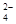 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 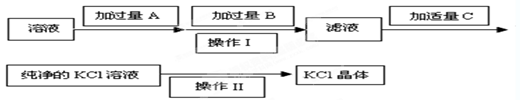
(1)上述试剂中, B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份无色稀溶液中可能含有Na+、Fe3+、H+、Mg2+、CO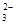 、OH-、HCO
、OH-、HCO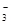 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①用石蕊试纸测溶液的酸碱性,试纸显蓝色;
②取2毫升溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经过上述操作后,还不能肯定是否存在的离子是 。请你设计一个简单的实验方案来判断是否存在这种离子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。
④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有 ,一定没有 ,可能含有________________。
(2)对可能含有的物质,如何进行实验以进一步检验。 。
(3)实验④中发生的化学反应属于 反应(填反应类型),主要实验操作名称叫 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题:
(1)生产普通玻璃的主要原料是______。
(2)PbSO4难溶于水,易溶于醋酸钠溶液,且发生复分解反应,化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb,该反应的离子方程式为 。
(3)铁制品在潮湿的空气中易被氧化而锈蚀。以下是探究铁制品在潮湿的空气中铁元素被氧化价态的一个实验方案,请你将它补充完整(检验铁元素的价态必须使用中学化学中最灵敏的试剂):取铁锈样品,
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。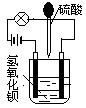
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。
(4)若用98%、1.84g/mL的浓硫酸配制上述浓度的硫酸溶液2500mL,需要多少毫升的浓硫酸(精确到0.1mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________>__________>__________。
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为_______________。
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式______________。
②工业生产时需在反应物中加少量Cl-,其作用是________________。
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为____________。
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问: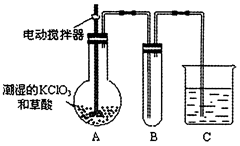
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置___________;
②C中应装的试剂为____________。C中发生反应的化学方程式为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com