
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
实验步骤 | 实验现象 |
(1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
(2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
(3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
(4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
(5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
(1)Fe2+、HCO3-、I-、Ba2+;NO3-、SO42-、Mg2+、Al3+
(2)Cl-的检验:取少量原溶液加足量的Ba(NO3)2溶液,过滤后,向滤液中加AgNO3溶液,生成白色沉淀,再加入稀硝酸,若沉淀不溶解可证明有Cl-
【解析】由步骤(1)的现象可知溶液呈酸性,故可以确定HCO3-一定不存在。由步骤(2)的现象可知原溶液中一定含有NO3-,因NO3-在酸性条件下具有强氧化性,故Fe2+、I-肯定不能存在。由步骤(3)知原溶液中一定含有SO42-,则Ba2+肯定不存在。由于步骤(3)中加入了BaCl2溶液,引入了Cl-,故步骤(4)中虽然产生了不溶于稀HNO3的白色沉淀,但不能说明原溶液中一定含有Cl-。由步骤(5)的现象可知原溶液中肯定有Mg2+和Al3+。由上述分析可知溶液中可能存在的阴离子为Cl-,检验时应首先用Ba(NO3)2溶液除去原溶液中的SO42-,过滤后,向滤液中加入AgNO3溶液,再加入稀硝酸,若生成白色沉淀且不溶解可证明有Cl-


科目:高中化学 来源:2014年高考化学苏教版总复习 11-3 常见的烃练习卷(解析版) 题型:选择题
某有机物的结构简式为:
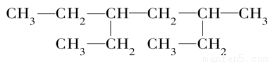
下列说法不正确的是( )
A.该有机物属于饱和烷烃
B.该烃的名称是3?甲基?5?乙基庚烷
C.该烃与2,5?二甲基?3?乙基乙烷互为同系物
D.该烃的一氯取代产物共有8种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷(解析版) 题型:选择题
下列实验能达到预期目的的是( )
A.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnCl2溶液
D.用氢氧化铜粉末检测尿糖
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-3 常见气体的制备练习卷(解析版) 题型:选择题
可用如图所示装置制取、净化、收集的气体是( )
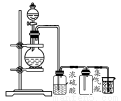
A.锌和稀硝酸反应制一氧化氮
B.亚硫酸钠与浓硫酸反应制二氧化硫
C.铁和稀硫酸反应制氢气
D.浓氨水和生石灰反应制取氨气
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-3 常见气体的制备练习卷(解析版) 题型:选择题
如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是( )
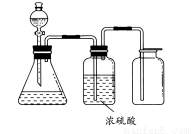
A.铜屑和稀硝酸 B.二氧化锰和浓盐酸
C.用浓氨水和生石灰反应 D.碳酸钙和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
取少量无机盐溶液,对其中的离子进行检验。下列判断正确的是( )
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+
D.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:填空题
制备Cl2需用8mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
(1)需要用量筒量取12 mol·L-1的盐酸的体积为 mL;
(2)实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.100mL烧杯 H.100mL容量瓶
(3)下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-1 物质的分类、转化及分散系练习卷(解析版) 题型:选择题
我国科学家在世界上第一次为一种名为“钴酞箐”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞箐”分子的结构和性质与人体内的血红素和植物的叶绿素非常相似。下列关于“钴酞箐”分子的说法中正确的是 ( )
A.它的分子直径比Na+小
B.它的分子既能透过滤纸,也能透过半透膜
C.在水中形成的分散系能产生丁达尔效应
D.在水中所形成的分散系属悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com