
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
分析 A.锗位于金属与非金属的分界线处,为良好的半导体材料;
B.金属性越强,最高价氧化物对应的水化物的碱性越强;
C.根据碳酸镁、碳酸钡的性质判断具有SrCO3的性质;
D.根据氯化银、溴化银和碘化银的性质可知砹化银(AgAt)为有色沉淀.
解答 解:A.锗是ⅣA族元素,位于金属与非金属的分界线处,它的单质晶体是一种良好的半导体材料,故A正确;
B.同主族元素从上到下,元素的金属性逐渐增强,同周期元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物的水化物的碱性增强,则碱性:RbOH>KOH>Ca(OH)2,故B正确;
C.同主族元素的性质具有相似性,碳酸钙、碳酸镁都是不溶于水的白色沉淀,则SrCO3是白色难溶于水易溶于盐酸的化合物,故C正确;
D.氯化银、溴化银、碘化银的颜色逐渐加深,则砹化银(AgAt)不是白色沉淀,故D错误;
故选D.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,明确元素周期表结构、元素周期律的内容为解答关键,试题充分考查了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
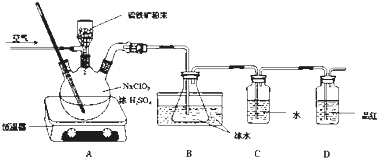
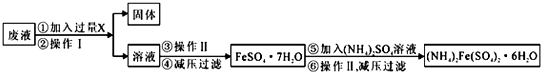
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com