
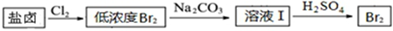
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
分析 (1)电解氯化钠溶液在阴极生成氢氧化钠和氢气,阳极生成氯气;
(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据得失电子守恒和原子守恒配平方程式;
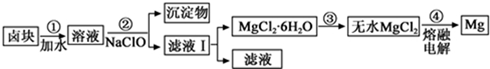
(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去;
②次氯酸钠具有氧化性,把氧化亚铁离子为三价铁,据此写出反应的离子方程式;
③镁离子水解显酸性,通入HCl可以抑制其水解;
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,根据方程式计算.
解答 解:(1)电解氯化钠溶液在阴极生成氢氧化钠和氢气,阳极生成氯气,其电解反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,
故答案为:3、3、1、5NaBr、3CO2;
(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
故答案为:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl-和H+,反应的离子方程式为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
故答案为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2O?Mg(OH)2+2H+,水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;
故答案为:Mg2++2H2O?Mg(OH)2+2H+;
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,故答案为:22.35.
点评 本题考查较为综合,涉及方程式的书写、实验仪器的选择、物质的制备原理,涉及知识点较多,题目侧重于反应原理的应用和元素化合物性质的考查,题目综合性较强,难度中等,充分考查了学生的分析、理解能力及化学实验能力.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:多选题
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氢氧化钠(氢氧化钡) | 稀硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
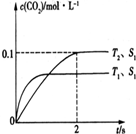 目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.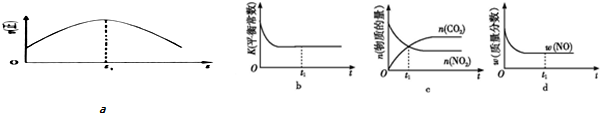
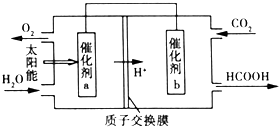
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
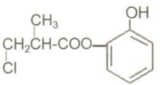
| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1molA和足量的H2发生加成反应,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液发生反应,最多可以消耗 4molNaOH | |
| D. | 有机物A不能在稀硫酸下水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(气体)+O2(气体)?2NO(气体) 正反应吸热 | |
| B. | NH4HCO3(固体)?NH3(气体)+H2O(气体)+CO2(气体) 正反应吸热 | |
| C. | 3O2(气体)?2O3(气体) 正反应吸热 | |
| D. | 2NO2(气体)?N2O4(气体) 正反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com