
【题目】某元素最高价氧化物对应水化物的化学式为H2XO3。这种元素的气态氢化物的化学式是( )
A.HXB.H2XC.XH3D.XH4
科目:高中化学 来源: 题型:
【题目】H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1molL﹣1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式: .
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 | 0.1molL﹣1Fe2(SO4)3 | 30% H2O2 | H2O |
1 | 0.5 | 15 | |
2 | 0.5 | 30 | 9.5 |
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为(设溶液体积变化忽略不计)
(2)利用图2﹣(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,将合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 , 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1mol
B.合金中,铜的质量为2.8g
C.原硝酸的浓度:c(HNO3)=4.5molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5molL﹣1的NaOH溶液60mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn , B原
子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是;A、B、D、E四种元素的第一电离能由大到小的顺序为(用元素符号表示).
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是 . 分子的立体构型为
, 该氢化物易溶于D的简单氢化物的主要原因是 .
(3)D原子分别与A、B原子形成的单键中,键的极性较强是(用具体的化学键表示).
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是 .
a.该晶体的化学式为AD b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高 d.该晶体可溶于水.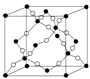
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
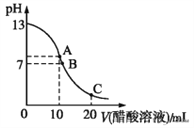
A. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-)
C. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合如图判断,下列正确的说法是( ) 
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe﹣2e﹣═Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e﹣═4OH﹣
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应又属于放热反应的是( )
A.CH3COOH溶液与NaOH溶液混合
B.Al与Fe2O3高温下的铝热反应
C.KMnO4分解制氧气
D.Na2CO3在溶液中的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
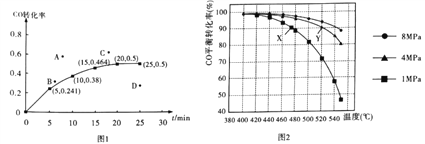
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中![]() 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com