
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn , B原
子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是;A、B、D、E四种元素的第一电离能由大到小的顺序为(用元素符号表示).
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是 . 分子的立体构型为
, 该氢化物易溶于D的简单氢化物的主要原因是 .
(3)D原子分别与A、B原子形成的单键中,键的极性较强是(用具体的化学键表示).
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是 .
a.该晶体的化学式为AD b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高 d.该晶体可溶于水.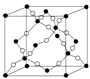
【答案】
(1)1s22s22p63s23p63d5;Si<C<O<N
(2)sp3;三角锥型;NH3与H2O分子间易形成氢键
(3)C﹣O
(4)c
【解析】解:A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.①F的单质为生活中最常见的金属之一,原子最外层有2个电子,则F为Fe元素;③A、D原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2 , 则A为碳元素;D核外电子排布式为1s22s22p4 , 则D为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;②E原子价电子(外围电子)排布为msnmpn , s能级容纳2个电子,则E的价电子排布为为ms2mp2 , 原子序数大于氧元素,则E为Si元素.
(1.)F为Fe元素,Fe的稳定价态离子Fe3+的电子排布式是1s22s22p63s23p63d5;同周期主族元素从左到右第一电离能增大,但是第IIA和第IIIA,第VA和第VIA族反常,同主族从上到下第一电离能减小,所以C、N、O、Si的第一电离能由大到小的顺序为Si<C<O<N;所以答案是:1s22s22p63s23p63d5;Si<C<O<N;
(2.)B为氮元素,其氢化物为NH3 , NH3中N原子的杂化类型为sp3;分子的空间构型为三角锥型;NH3与H2O分子间易形成氢键,所以氨气易溶于水;所以答案是:sp3;三角锥型;NH3与H2O分子间易形成氢键;
(3.)两种非金属元素的电负性差别越大,形成的共价键的极性就越大,O与C、N形成的共价键中C﹣O的极性大;所以答案是:C﹣O;
(4.)A为C元素,D为O元素,黑球可以形成4个共价键,所以黑球为C,白球为O;a.黑球在顶点、面心和晶体内部,黑球个数为 ![]() =8,白球全部在晶胞内部有16个,所以晶体的化学式为AD2 , 故a错误;b.该晶体中有的黑球连接4个白球,有的连接2个白球,所以A、D原子间形成的是单键和双键,故b错误;c.该晶体为空间网状结构,为原子晶体,C原子半径小于Si,所以熔点可能比SiO2晶体高,故c正确;d.该晶体为原子晶体,原子晶体难溶于水,故d错误.所以答案是:c.
=8,白球全部在晶胞内部有16个,所以晶体的化学式为AD2 , 故a错误;b.该晶体中有的黑球连接4个白球,有的连接2个白球,所以A、D原子间形成的是单键和双键,故b错误;c.该晶体为空间网状结构,为原子晶体,C原子半径小于Si,所以熔点可能比SiO2晶体高,故c正确;d.该晶体为原子晶体,原子晶体难溶于水,故d错误.所以答案是:c.


科目:高中化学 来源: 题型:
【题目】1869 年,俄国化学家门捷列夫制作出了第一张元素周期表,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族
B.元素周期表有 18 个族
C.第ⅠA 族的元素全部都是金属元素
D.短周期是指第一、二、三、四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L1mol·L-1FeCl3溶液与0.4L1mol·L-1KCl溶液中的Cl-的物质的量浓度之比为
A.3:1B.5:2C.15:2D.1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com