
【题目】1869 年,俄国化学家门捷列夫制作出了第一张元素周期表,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族
B.元素周期表有 18 个族
C.第ⅠA 族的元素全部都是金属元素
D.短周期是指第一、二、三、四周期
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) .
A.C5H12O3
B.C4H10
C.C6H10O4
D.C5H10O
(3)①B的结构简式是 . ②A不能发生的反应是(填序号) .
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱图如图所示,下列说法中错误的是( ) 
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.若A的化学式为C2H6O,则其结构简式为CH3﹣O﹣CH3
C.仅由其核磁共振氢谱图无法得知其分子中的氢原子总数
D.由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应2X(g)+Y(g)2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( ) 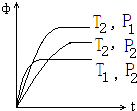
A.T1<T2 , P1<P2 , Q>0
B.T1>T2 , P1>P2 , Q>0
C.T1>T2 , P1>P2 , Q<0
D.T1<T2 , P1<P2 , Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
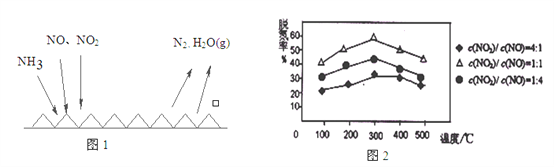
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 该反应的还原产物为 .
(2)上述浓缩液中含有I﹣、Cl﹣等离子,取一定量的浓缩液,向其中不断滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 ![]() 为: , 已知Ksp(AgCl)=1.7×10﹣10 , Ksp(AgI)=8.5×10﹣17 .
为: , 已知Ksp(AgCl)=1.7×10﹣10 , Ksp(AgI)=8.5×10﹣17 .
(3)已知反应2HI(g)H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ.
(4)已知反应:H2(g)+I2(g)2HI(g),在457.6℃时,将0.2molH2和0.1mol I2气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得HI的体积分数为20%,则该反应的平衡常数K为:(必须先列出表达式并计算出结果).
(5)已知次碘酸钠是一种氧化剂,比次氯酸钠和次溴酸钠稳定.25℃时HIO的电离常数为2.5×10﹣9 , 则该温度下0.01mol/L的NaIO溶液的pH=(提示:lg5=0.7,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1molL﹣1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式: .
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 | 0.1molL﹣1Fe2(SO4)3 | 30% H2O2 | H2O |
1 | 0.5 | 15 | |
2 | 0.5 | 30 | 9.5 |
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为(设溶液体积变化忽略不计)
(2)利用图2﹣(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸
D.钠的金属性比钾强,工业上用钠制取钾(Na+KCl ![]() ?K↑+NaCl)
?K↑+NaCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn , B原
子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是;A、B、D、E四种元素的第一电离能由大到小的顺序为(用元素符号表示).
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是 . 分子的立体构型为
, 该氢化物易溶于D的简单氢化物的主要原因是 .
(3)D原子分别与A、B原子形成的单键中,键的极性较强是(用具体的化学键表示).
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是 .
a.该晶体的化学式为AD b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高 d.该晶体可溶于水.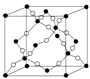
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com