
【题目】密闭容器中,反应2X(g)+Y(g)2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( ) 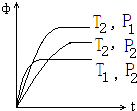
A.T1<T2 , P1<P2 , Q>0
B.T1>T2 , P1>P2 , Q>0
C.T1>T2 , P1>P2 , Q<0
D.T1<T2 , P1<P2 , Q<0
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.![]()
B.(2b﹣a)mol/L
C.![]()
D.(10b﹣5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题。
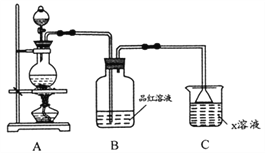
(1)利用上图装置研究铜与浓硫酸反应,反应化学方程式为_________;B装置的目的是______;x溶液为___________。
(2)将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为____,气体产生越来越快的原因可能是_____(至少两点)。验证该气体的实验方案如下:
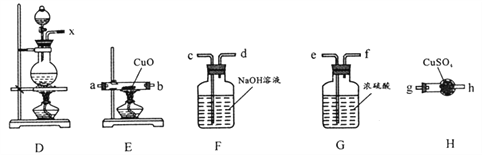
①装置连接顺序:x→_________;
②能证明上述假设成立的实验现象是__________。
(3)取少量镁粉加入盛浓硫酸的烧杯,在通风橱中实验。充分反应后溶液中有灰白色悬浮物,设计方案研究该悬浮物的组成,请帮助完善。(假设镁的化合物都溶于稀酸)
![]() _____
_____
写出产生该灰白色悬浮物主要反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究题
Ⅰ.某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)写出A的结构简式 .
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”).
(3)Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式为: 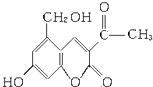
它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
①下列有关“亮菌甲素”的叙述正确的是(填字母).
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”的分子式是C12H10O5
D.“亮菌甲素”分子中含氧官能团只有2种
②丙二醇的分子式是C3H8O2 , 已知两个羟基连在同一个碳原子上的物质不存在.写出其所有属于醇类的同分异构体的结构简式.
③依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2:2:1.又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1mol二甘醇与足量金属钠反应生成1mol H2 . 写出二甘醇的结构简式. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是( )
A.明矾可用作净水剂
B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多
D.铝制容器可长期存放酸性食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869 年,俄国化学家门捷列夫制作出了第一张元素周期表,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族
B.元素周期表有 18 个族
C.第ⅠA 族的元素全部都是金属元素
D.短周期是指第一、二、三、四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于放热反应的是( )
①H2SO4 与 Ba(OH)2 溶液的反应 ②Mg 与 CH3COOH 溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
A.仅①②③B.仅①②④
C.仅①②③④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com