
 下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、
下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、 NaOH溶液等试剂)
NaOH溶液等试剂) (1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(1)操作a的名称为 ,所需要的玻璃仪器为 ____。 ____,加入的试剂④为 __,发生的化学方程式为 。
____,加入的试剂④为 __,发生的化学方程式为 。  的是 ____________。
的是 ____________。 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.若锌粉有剩余, 则不溶物中一定有铜,可能有铁 |
| B.若锌粉有剩余, 则溶液中的金属阳离子只有Zn2+ |
| C.若锌粉无剩余, 且溶液中尚存有Cu2+, 则一定有Fe2+ |
| D.若锌粉无剩余, 且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
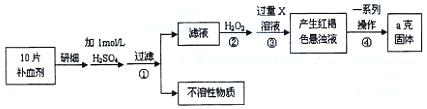
 请回答下列问题:
请回答下列问题: 铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的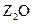 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。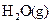 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。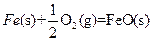
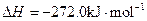

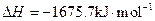
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的变化如图所示。下列离子方程式错误的是( )
的变化如图所示。下列离子方程式错误的是( )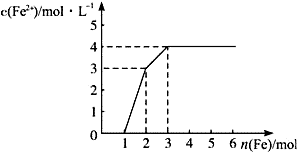
| A.0~1 : Fe+ NO3—+4H+=Fe3++ NO↑+2H2O | B.1~2 : Fe+2Fe3+ =3Fe2+ |
| C.2~3 : Fe+Cu2+=Fe2++Cu | D.0~3 : 3Fe+2Fe3++2Cu2+ =5Fe2++2Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示:
 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁在氯气中燃烧 | B.加热硫粉和铁粉的混合物 |
| C.铁在氧气中燃烧 | D.水蒸气通过灼热的铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.b≥40y(2-) | B.b≥8 0y(2-) 0y(2-) |
| C.b≥40y(1-) | D.b≥80y(1-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是
3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是| A.1/2mol | B.1/3mol | C.3mol | D.9mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com