
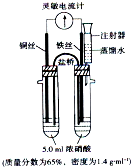
 为探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图.开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝.再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停 止实验,重复三次实验得平均加水量为2.5mL.下列说法错误的是( )
为探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图.开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝.再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停 止实验,重复三次实验得平均加水量为2.5mL.下列说法错误的是( )| 5.0×1.4×65% |
| 5.0×1.4+2.5 |


科目:高中化学 来源: 题型:阅读理解
 (2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源:2012届浙江省绍兴市第一中学高三回头考试化学试卷 题型:填空题
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H=+180.5 kJ/mol
2C(s)+ O2(g)="2CO(g)" △H="-221.0" kJ/mol
C(s)+ O2(g)=CO2(g) △H="-393.5" kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com