
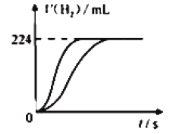
【题目】量取8.0mL 5.0 molL-1 H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。下列说法正确的是
A.稀释后H2SO4溶液的物质的量浓度为0.04 molL-1
B.加入Fe的质量至少有0.56 g
C.反应过程中铁粉过量
D.金属Zn与硫酸反应转移电子数为0.01NA
【答案】C
【解析】
根据题给条件和图可知,产生的H2相等,必有:消耗的硫酸相等,消耗的Zn和Fe物质的量相等。由于等质量Fe比Zn物质的量多,所以Fe必有剩余,则与Fe反应的硫酸消耗完;两个反应消耗的硫酸相等,所以与Zn反应的硫酸也消耗完;而Zn可能反应完,也可能没有反应完。可在此基础上并对各选项作出判断。
A. 稀释后H2SO4溶液的物质的量浓度为5.0 molL-1×8.0÷100=0.4 molL-1,A选项错误;
B. 产生的H2物质的量为224×10-3L÷(22.4 Lmol-1)=0.01mol,根据分析,Fe有剩余,所以Fe的质量大于0.01mol×56 gmol-1=0.56 g,不能等于0.56 g,B选项错误;
C. 产生的H2相等,则消耗的Zn和Fe物质的量相等,等质量Fe比Zn物质的量多,所以Fe必有剩余,C选项正确;
D. 金属Zn与硫酸反应转移电子数为0.01mol×2×NA mol-1=0.02NA,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

(1)从“正极”可以回收的金属有___________________。
(2)“碱溶”时Al箔溶解的离子方程式_________________________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为_________mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO![]() )=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
)=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl![]() +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2= SnCl![]() +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O![]() +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是________________________。
②磷酸亚铁锂电池中铁的含量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的综合利用对温室气体的减排以及对减缓燃料危机等具有重要意义。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
该催化重整反应的ΔH=____kJ·mol-1。
(2)CH4-CO2催化重整反应通过热力学计算可得到的图像之一如图。
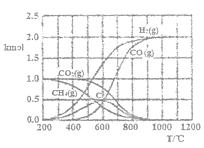
①200—400℃时,主要发生的反应的化学方程式为___。
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是__(用文字表达)。
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
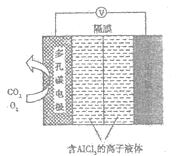
电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2。
+6O2。
反应过程中O2的作用是___。电池的负极反应式为___。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。
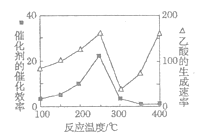
①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为___。
②300~400℃时,乙酸的生成速率升高的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
①三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
②碳酸镁与稀硫酸:MgCO3+2H+=H2O+CO2↑+Mg2+
③醋酸与大理石:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
④Fe2+与H2O2(酸性):2Fe2++H2O2+2H+=2Fe3++2H2O
⑤钠与CuSO4溶液:2Na+Cu2+=2Na++Cu
⑥碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
A.①③④⑥B.②③④C.②③④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Iˉ、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀;
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A.(2)中产生的气体可能含有SO2
B.溶液X中一定存在![]() 、
、![]() 、Mg2+
、Mg2+
C.溶液X中一定不存在Fe3+,可能存在Iˉ
D.无法确定溶液中是否含有Na+,需要做焰色反应才能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL某溶液中可能含有Na+、NH4+、Mg2+、Ba2+、CO32-、SO42-、Cl-中的若干种,现将此溶液分成三等份,进行如下实验:
①向第一份中加入AgNO3溶液,有白色沉淀产生;
②向第二份中加足量KOH溶液并加热,收集到气体0.04 mol;(铵盐与碱共热可产生氨气)
③向第三份中加足量BaCl2溶液,得到沉淀6.27g,加入足量盐酸充分反应后,剩余沉淀2.33g。根据上述实验,回答下列问题:
(1)实验③中生成沉淀的离子方程式为________,沉淀溶解的离子方程式为__________。
(2)溶液中一定不存在的离子有_________。
(3)实验①中加入AgNO3溶液,有沉淀产生,能否说明原溶液中含有Cl-?________(填“能”或“否”)理由是______________。
(4)推断钠离子是否存在并说明理由_________。若存在,计算其物质的量的浓度____________(若不存在,此问不作答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___,B:____,C:____,D:____。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___,D:___。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____。
(4)写出B2A4的电子式:____。
(5)写出C3B2化合物与水反应的方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com