【答案】
分析:(1)实验室通常用二氧化锰与浓盐酸共热的方法制备氯气;(2)根据CH
4、H
2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式,据此计算;
(3)CHCl
3中碳为+2价,COCl
2中碳为+4价,故H
2O
2中氧元素化合价由-1价降低为-2价,生成H
2O,由电子转移守恒与原子守恒可知可知,CHCl
3、H
2O
2、COCl
2、H
2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成;
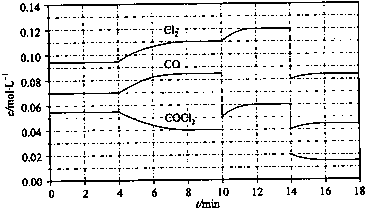
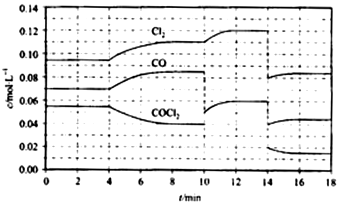
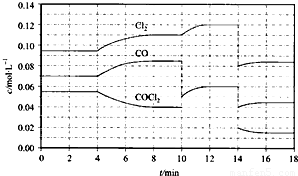
(4)①由图可知,8min时COCl
2的平衡浓度为0.04mol/L,Cl
2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,据此结合温度对平衡影响判断;
③由图可知,10min瞬间Cl
2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl
2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl
2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,据此判断;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答:解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气与水制取氯气,反应方程式为:
2MnO
2+4HCl(浓)
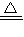
2MnCl
2+Cl
2↑+2H
2O,故答案为:2MnO
2+4HCl(浓)
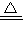
2MnCl
2+Cl
2↑+2H
2O;
(2)根据CH
4、H
2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O
2(g)+2H
2(g)=2H
2O(L)△H=-571.6kJ?mol
-1;
②CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(L)△H=-890.3kJ?mol
-1;
③2CO(g)+O
2(g)=2CO
2(g)△H=-566.03kJ?mol
-1,
利用盖斯定律将②-①-③可得:CH
4(g)+CO
2(g)=2CO(g)+2H
2(g);△H=+247.3 kJ?mol
-1,
即生成2molCO,需要吸热247.3 KJ,那么要得到1立方米的CO,吸热为
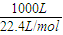
×
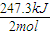
=5.52×10
3KJ;
故答案为:5.52×10
3KJ;
(3)CHCl
3中碳为+2价,COCl
2中碳为+4价,故H
2O
2中氧元素化合价由-1价降低为-2价,生成H
2O,由电子转移守恒与原子守恒可知可知,CHCl
3、H
2O
2、COCl
2、H
2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl
3+H
2O
2=HCl+H
2O+COCl
2,故答案为:CHCl
3+H
2O
2=HCl+H
2O+COCl
2;
(4)①由图可知,8min时COCl
2的平衡浓度为0.04mol/L,Cl
2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下化学平衡常数k=
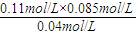
=0.234 mol?L
-1,故答案为:0.234 mol?L
-1;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8),故答案为:<;
③由图可知,10min瞬间Cl
2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl
2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
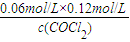
=0.234mol/L,解得c(COCl
2)=0.031mol/L,故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:>;在相同温度时,该反应的反应物的浓度越高,反应速率越大.
点评:本题涉及化学方程式、热化学方程式的书写和化学平衡图象的有关计算,意在考查考生对反应热、化学平衡等化学反应原理掌握的情况,难度中等.

 2MnCl2+Cl2↑+2H2O,故答案为:2MnO2+4HCl(浓)
2MnCl2+Cl2↑+2H2O,故答案为:2MnO2+4HCl(浓) 2MnCl2+Cl2↑+2H2O;
2MnCl2+Cl2↑+2H2O;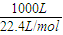 ×
×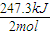 =5.52×103KJ;
=5.52×103KJ;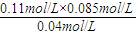 =0.234 mol?L-1,故答案为:0.234 mol?L-1;
=0.234 mol?L-1,故答案为:0.234 mol?L-1;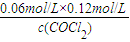 =0.234mol/L,解得c(COCl2)=0.031mol/L,故答案为:0.031;
=0.234mol/L,解得c(COCl2)=0.031mol/L,故答案为:0.031;

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案