
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,1molP4(P原子均达到8电子稳定结构)中所含P-P键数目为4NA
B.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数小于0.2NA
C.20mL10mol/L的浓硝酸与足量铜加热反应转移电子数为0.1NA
D.0.1molNH2-所含电子数为6.02×1023个
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.磷酸溶于水的电离方程式:H3PO4=3H+ + PO43-
B.用电子式表示 HCl 的形成过程:![]()
C.S2-的结构示意图: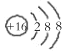
D.KClO 碱性溶液与Fe(OH)3反应:3ClO- + 2Fe(OH)3=2FeO42- + 3Cl- + 4H+ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是

A. 已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:![]()
B. 相同条件下,Ea越大反应速率越慢
C. 图中ΔH<0,其大小与Ea1、Ea2无关
D. CH4转化为CH3Cl的过程中,所有C-H发生了断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)![]() 2HI(g) ΔH1=-9.48 kJ·mol-1
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g) ΔH2=+26.48 kJ·mol-1
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知: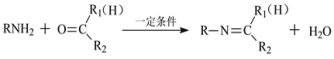
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
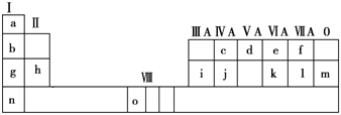
试回答下列问题:
(1)请写出元素o的基态原子电子排布式__________________________________。
(2)d的氢化物的分子构型为____________,中心原子的杂化形式为________;k在空气中燃烧产物的分子构型为________,中心原子的杂化形式为________,该分子是________(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序排列如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是________,试从结构角度加以解释______________。
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
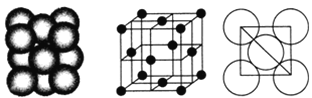
甲 乙 丙
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
②该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用多孔石墨电极完成下列实验,下列解释或推断不合理的是( )
实验 |
| ||
现象 | (i)中a、b两极均有气泡产生 | (ii)中b极上析出红色固体 | (iii)中b极上析出灰白色固体 |
A.(i)中,a电极上既发生了化学变化,也发生了物理变化
B.电解一段时间后,(i)中溶液浓度不一定会升高
C.(ii)中发生的反应为H2+Cu2+=2H++Cu↓
D.(iii)中发生的反应只可能是2Ag+Cu=2Ag++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
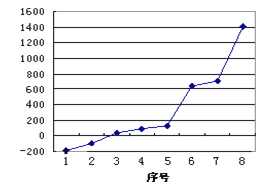
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g) △H<0达到甲平衡,在仅改变某一条件后,达到乙平衡,对此条件的分析正确的是( )
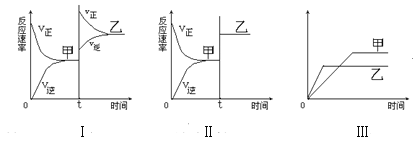
A. 图Ⅰ是增大反应物浓度
B. 图Ⅱ可能是加入正催化剂
C. 图Ⅱ可能是增大压强
D. 图Ⅲ是增大压强或升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com