
2013������������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
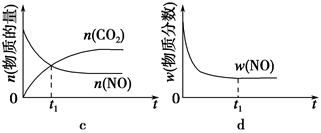
��1������β����������Ҫԭ��Ϊ2NO��g����2CO��g�� 2CO2��g����N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ��ʾ��
2CO2��g����N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ��ʾ��
�ݴ��жϣ�
�ٸ÷�Ӧ�Ħ�H________0���>����<������
����T2�¶��£�0��2 s�ڵ�ƽ����Ӧ����v��N2����________��
�۵��������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1>S2������ͼ�л���c��CO2����T1��S2�����´ﵽƽ������еı仯���ߡ�
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����________������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
���磺CH4��g����2NO2��g��=N2��g����CO2��g����2H2O��g������H1����867 kJ��mol��1
2NO2��g�� N2O4��g������H2����56.9 kJ��mol��1
N2O4��g������H2����56.9 kJ��mol��1
д��CH4��g������ԭN2O4��g������N2��g����CO2��g����H2O��g�����Ȼ�ѧ����ʽ��__________________________________________________________________
�ڽ�ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ġ���ͼ��ͨ���˹�������ã���CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦʽΪ_______________________________________��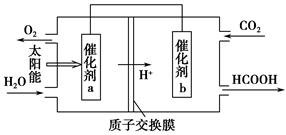
�۳����£�0.1 mol��L��1��HCOONa��ҺpHΪ10����HCOOH�ĵ��볣��Ka��________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ������������֪��
��2C3H8(g) ��7O2(g) = 6CO(g)��8H2O(g) ��H = ��2389.8 kJ/mol
��2CO(g) + O2(g) = 2CO2(g) ��H = ��566 kJ/mol
��H2O(l) = H2O(g) ��H =" +" 44.0 kJ/mol
��1��д��C3H8ȼ��ʱȼ���ȵ��Ȼ�ѧ����ʽ ��
��2��C3H8�ڲ�������������ȼ�գ�����CO��CO2��H2O(g)�������еIJ���ͨ��һ������̶����ܱ�
�����У���һ�������·������¿��淴Ӧ�� CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
�÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| | H2O | CO | CO2 | H2 |
| �� ������/g�� | 1.8 | 8.4 | a | 1 |
| �� ������/g�� | 1.8 | 2.8 | 0 | 0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡����ṩH2ȼ�շ�Ӧ���й����ʵĻ�ѧ�����ܣ� H��H������ΪQ1 kJ��mol��1��H��O������ΪQ3 kJ��mol��1��O2��������ԭ�Ӽ�ļ���ΪQ2 kJ��mol��1��
(1)������������ݣ���ͼ�б�ע�����ִ�����������仯����ֵ����ݼ�ͷ��ָ����д�����仯�ǡ��ų����������ǡ����ա�������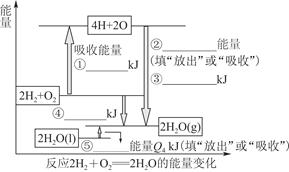
(2)��д��1 molH2ȼ������Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
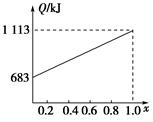
����ʱ��2013��12��2���賿1ʱ30�֣��ҹ��ġ��϶����š�����̽�������������Ƿ������ķ�������,���䡰�϶����š�����̽�����Ļ���ƽ�����װ�л�ԭ����(N2H4)��������N2O4�������ǻ��ʱ�������������ĵ�����ˮ���������ų��������ȡ���֪0.4 mol��̬�º�����N2O4���巴Ӧ���ɵ�����ˮ����ʱ�ų�219.3 kJ��������
��1��д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�� ��
��2����֪H2O(l)��H2O(g)����H����44 kJ��mol��1����16 g��̬��������N2O4���巴Ӧ���ɵ�����Һ̬ˮʱ���ų��������� ��
��3���³�Ӧ���ڻ��ȼ���⣬������Ϊȼ�ϵ�ص�ȼ�ϣ����ºͿ������ɵļ���ȼ�ϵ�صĸ�����ӦʽΪ�� ��������ӦʽΪ�� ��
��4�������������Һ��ͨ��һ�����ʵ����İ����������£�д����Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij������ȼ���ɼס��������л����϶��ɣ��ס����������ʺ���C��H��O����Ԫ���е����ֻ����֡���֪�ס��Ҽ�CO��H2��ȼ�������£�
| ���� | �� | �� | CO | H2 |
| ȼ����/(kJ��mol��1) | 1 366 | 5 518 | 283 | 286 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��úת��Ϊˮú������Ҫ��ѧ��ӦΪC(s)��H2O(g)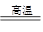 CO(g)��H2(g)��C(s)��CO(g)��H2(g)��ȫȼ�յ��Ȼ�ѧ����ʽΪ��
CO(g)��H2(g)��C(s)��CO(g)��H2(g)��ȫȼ�յ��Ȼ�ѧ����ʽΪ��
C(s)��O2(g)=CO2(g)����H1����393.5 kJ��mol��1
H2(g)��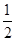 O2(g)=H2O(g)����H����242.0 kJ��mol��1
O2(g)=H2O(g)����H����242.0 kJ��mol��1
CO(g)��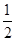 O2(g)=CO2(g)����H����283.0 kJ��mol��1
O2(g)=CO2(g)����H����283.0 kJ��mol��1
��ش�
(1)�����������ݣ�д��C(s)��ˮ������Ӧ���Ȼ�ѧ��Ӧ����ʽ��_______________________________��
(2)�ȽϷ�Ӧ�����ݿ�֪��1 mol CO(g)��1 mol H2(g)��ȫȼ�շų�������֮�ͱ�1 mol C(s)��ȫȼ�շų��������ࡣ��ͬѧ�ݴ���Ϊ��úת��Ϊˮú������ʹúȼ�շų����������������ͬѧ���ݸ�˹����������ͼѭ��ͼ
���ݴ���Ϊ��úת��Ϊˮú����ȼ�շų���������úֱ��ȼ�շų���������ȡ���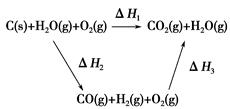
��������ס�����ͬѧ�۵���ȷ����________(��ס����ҡ�)���жϵ�������________________________________________________________��
(3)��úת��Ϊˮú����Ϊȼ�Ϻ�úֱ��ȼ������кܶ��ŵ㣬���о����е������ŵ�___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Դ�����ǵ�ǰ����������ٵ�һ���ش���⣬H2��CO��CH3OH������Ҫ����Դ���ʣ����ǵ�ȼ��������Ϊ285.8 kJ/mol��282.5 kJ/mol��726.7 kJ/mol����ش�
(1)��֪CO��H2��һ�������¿��Ժϳɼ״���CO+2H2=CH3OH����H2��CO��Ӧ����CH3OH���Ȼ�ѧ����ʽΪ�� ��
(2)��ͼΪij��ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��a��b��Ϊ���Ե缫��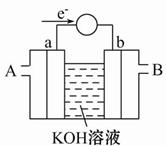
��ʹ��ʱ�������� ��ͨ��(�A����B��)��
�ڼ���ʹ�õġ�ȼ�ϡ��Ǽ״���a���ĵ缫��ӦʽΪ�� ________________
�ۼ���ʹ�õġ�ȼ�ϡ���ˮú��(�ɷ�ΪCO��H2)�����ֵ�ص��ͭ�����ƽ�������6.4 g�����������ı�״����ˮú�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ���Ʊ� BaC12 �Ĺ�������ͼ��ͼ��ʾ��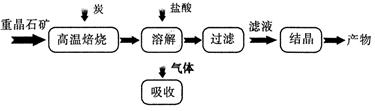
ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�顣����ã�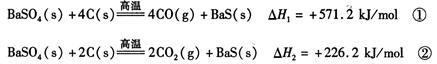
��1����ӦC(s) + CO2(g) 2CO(g)�ġ�H = kJ/mol
2CO(g)�ġ�H = kJ/mol
��2�����˹�������Ҫʹ�ò��������������������� ��
��3�������ܽⱺ�յĹ�������������ù��� NaOH ��Һ���գ��õ�������Һ�� Na2S ˮ������ӷ���ʽΪ ��
��4����BaCl2��Һ�м���AgNO3��KBr,�����ֳ�������ʱ��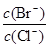 = ��[��֪��
= ��[��֪��
Ksp(AgBr) = 5.4��10��13 , Ksp(AgCl) = 2.0��10��10]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����̲��Ŵ����ġ���ȼ�������ü�����ˮú����CO��H2�����ٺϳɼ״����������湩Ӧ���ŵ�ȼ�͡�
��֪���� CH4(g)��H2O (g)��CO (g)��3H2 (g) ��H1��+206.2kJ��mol-1
�� CH4(g)��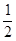 O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
�� CH4 (g)��2H2O (g)��CO2 (g)��4H2 (g) ��H3��+165.0 kJ��mol-1
��1��CH4(g)��CO2 (g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2����ԭ�ϡ���Դ���õĽǶȣ�������Ӧ����Ϊ�ϳɼ״������˷�����ԭ���� ��
��3��ˮú���е�H2����������NH3���ڽ���ϳ���ǰ����[Cu(NH3)2]Ac��Һ���������е�CO����ֹ�ϳ����еĴ����ж����䷴Ӧ�ǣ� [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)2]Ac��Һ����CO��������������Ӧ�� ��
��4����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����ʯī����������ͨ����飬�ڱ�״���£����ļ������VL��0��V��44.8 Lʱ������ܷ�Ӧ����ʽΪ ��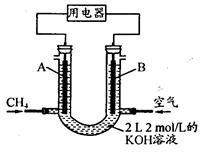
�� 44.8 L��V��89.6 Lʱ�������缫��ӦΪ ��
�� V="67.2" Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com