
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取其工艺流程如图所示.
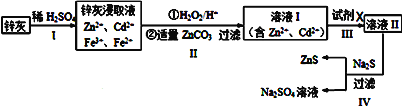
(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:
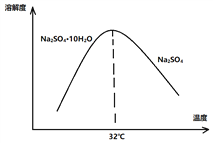
从滤液中得到Na2SO4的操作方法是_________________________________。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 molL-1时,Mn2+开始沉淀,则a=____________。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]
【答案】 Fe(OH)3 2Fe2++2H++H2O2=2Fe3++2H2O Na2SO4+CH4 ![]() Na2S+CO2+2H2O 蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥 5
Na2S+CO2+2H2O 蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥 5
【解析】(1)根据上面的分析可知,步骤Ⅱ所得滤渣中的物质是Fe(OH)3,故答案为:Fe(OH)3
(2)步骤Ⅱ中双氧水将亚铁离子氧化为铁离子,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(3)等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2SO4+CH4 ![]() Na2S+CO2+2H2O
Na2S+CO2+2H2O
(4)根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是:蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥。
(5)当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=a,H2S电离常数:K2=7.0×1015,HS浓度为1.0×104molL1时,则![]() ,则
,则![]() ,则c(S2)=7×10a19molL1,所以Ksp=c(Mn2+)c(S2)=7×10a19molL1×0.020molL1=1.4×1015解得a=5,故答案为:5。
,则c(S2)=7×10a19molL1,所以Ksp=c(Mn2+)c(S2)=7×10a19molL1×0.020molL1=1.4×1015解得a=5,故答案为:5。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A. 17g甲基(—l4CH3)中所含中子数为9NA
B. 28g乙烯和丙烯中的C原子数目为2NA
C. 300mL 2mol/L蔗糖溶液中含分子数为0.6NA
D. 标况下,1.12 L CC14含有的氯原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
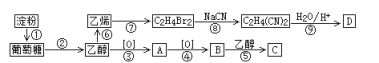
已知:R-CN![]() R-COOH
R-COOH
请回答下列问题:
(1)D的结构简式为____________________;
(2)反应⑧的类型为___________,B分子中的官能团名称为___________;
(3)反应⑤的化学方程式为_______________________;
(4)A发生银镜反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下有关细胞物质组成和功能的问题:
(1)水是活细胞和生物体中含量最多的化合物,人体中水的含量约占65%,下列选项中能正确说明水对人体重要性的是______________________。
①水和糖类、脂肪、蛋白质一样,能为人体提供能量
②没有水人体内大部分化学反应就根本不会发生
③水的比热小,有利于维持体温
④体内营养物质的运输离不开水
⑤水在人体组织器官中也可以结合水的形式存在
(2)糖类不仅是生物体生命活动的主要能源物质,还有许多重要作用,如下图:
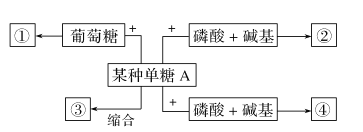
如果某种单糖A与葡萄糖缩合失去1分子水后形成的物质①遇斐林试剂不产生砖红色沉淀,则某种单糖A是________________。
如果某种单糖A缩合反应形成的物质③作为植物细胞壁的主要组成成分,则物质③是____________;如果某种单糖A与磷酸和碱基结合形成物质②,其中碱基是尿嘧啶,则形成的物质②是__________________;这说明糖类是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修-物质结构与性质】
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号)
(2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。
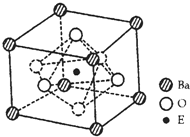
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______,
在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的O2和NH3混合成448 mL,通过预先加热的催化剂三氧化二铬充分反应后,再通过足量的水,最终收集到44.8mL的无色气体。则原混合气体中O2的体积可能是(氨全部被氧化;气体体积均已换算成标准状况)( )
A. 231.5 mLB. 268.8 mLC. 287.5 mLD. 56 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中表达正确的是( )
A. 第VⅡA族元素形成的氢化物中沸点最高的是HI
B. 水分子很稳定性是因为水分子间易形成氢键
C. 用电子式表示HCl形成过程:![]()
D. 第三周期元素形成的简单离子中,半径最小的是Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com