
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
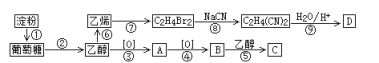
已知:R-CN![]() R-COOH
R-COOH
请回答下列问题:
(1)D的结构简式为____________________;
(2)反应⑧的类型为___________,B分子中的官能团名称为___________;
(3)反应⑤的化学方程式为_______________________;
(4)A发生银镜反应的化学方程式为_________________________。
【答案】HOOC-CH2-CH2-COOH 取代反应羧基CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2OCH3CHO+2Ag(NH3)2OH
CH3COOCH2CH3+H2OCH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
【解析】
根据流程,反应③、④为乙醇的两步氧化反应,A、B的结构简式依次为CH3CHO、CH3COOH;B与乙醇发生酯化反应生成具有果香味的C,C的结构简式为CH3COOCH2CH3;对比乙烯与C2H4Br2的分子式,反应⑦为乙烯与Br2的加成反应,反应⑦所得生成物的结构简式为BrCH2CH2Br;对比C2H4Br2和C2H4(CN)2,反应⑧所得生成物的结构简式为NCCH2CH2CN;结合题给已知,反应⑨发生题给已知的反应,D的结构简式为HOOCCH2CH2COOH;根据上述推断结果作答。
根据流程,反应③、④为乙醇的两步氧化反应,A、B的结构简式依次为CH3CHO、CH3COOH;B与乙醇发生酯化反应生成具有果香味的C,C的结构简式为CH3COOCH2CH3;对比乙烯与C2H4Br2的分子式,反应⑦为乙烯与Br2的加成反应,反应⑦所得生成物的结构简式为BrCH2CH2Br;对比C2H4Br2和C2H4(CN)2,反应⑧所得生成物的结构简式为NCCH2CH2CN;结合题给已知,反应⑨发生题给已知的反应,D的结构简式为HOOCCH2CH2COOH。
(1)根据上述推断,D的结构简式为HOOCCH2CH2COOH。
(2)反应⑧反应的化学方程式为BrCH2CH2Br+2NaCN→NCCH2CH2CN+2NaBr,溴原子被—CN取代,反应⑧为取代反应。B的结构简式为CH3COOH,B分子中官能团的名称为羧基。
(3)反应⑤为乙醇与乙酸的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(4)A为CH3CHO,CH3CHO发生银镜反应的化学方程式为CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O。
CH3COONH4+2Ag↓+3NH3+H2O。


科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为________________________;
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.CO2与乙醇的浓度之比不再改变
b.单位时间内消耗H2和CO2的物质的量之比为3∶1
c.H2的体积分数保持不变
d.混合气体的平均相对分子质量不再改变

(3)在一定压强下,测得由CO2制取乙醇的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
①升高温度,平衡向________(正或逆)反应方向移动。
②在700 K、起始投料比![]() =1.5时,H2的体积分数为________(保留小数点后一位)。
=1.5时,H2的体积分数为________(保留小数点后一位)。
③在500 K、起始投料比![]() =2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
=2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
Ⅱ 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(可逆反应,用化学方程式表示)________________________________,且汽缸内温度越高,单位时间内NO排放量越大,试分析其原因____________________。

(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①计算实验Ⅱ从开始至达到平衡时的反应速率v(NO)=________________。
②图中三组实验从开始至达到平衡时的反应速率v(NO)由小到大的顺序为________(填序号)。
③与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为:实验Ⅰ_______________________________;实验Ⅲ_______________________。
④三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)、αⅢ(CO)的大小关系为______________。判断依据为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:

(1)碳元素在周期表中的位置是______________。
(2)将硅的元素符号填写在上述周期表相应的空格中。________
(3)在上述周期表中,用实线画出周期表的上方边界。_______
(4)第118号元素为Og(中文名“![]() ”,ào),下列说法不正确的是____。
”,ào),下列说法不正确的是____。
a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.中子数为179的Og核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
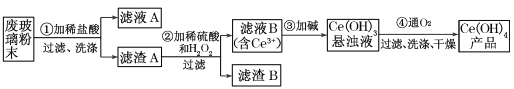
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取其工艺流程如图所示.
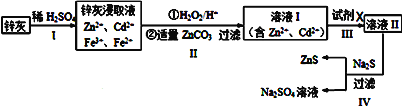
(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:
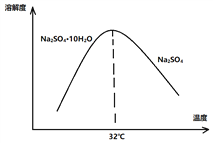
从滤液中得到Na2SO4的操作方法是_________________________________。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 molL-1时,Mn2+开始沉淀,则a=____________。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不法分子有时用铜锌合金制成假金币行骗。下列方法中,不能有效鉴别真假的是
A. 在空气中灼烧看表面是否变黑
B. 利用阿基米德原理测密度
C. 用手掂量轻重
D. 滴一滴硝酸在金币的表面,观察现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com