
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��F��ԭ��������������A��Dͬ�壬C��Eͬ�壬D���Ӻ�C���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��C��E��F�����γɹ����ͻ����A��C�γɵĻ�������ˮ�гʼ��ԣ�D��F�γɵĻ������������г�����ζ����A��B�ĺ��������֮�͵���F���������������ش��������⣺���û�ѧʽ����
��1��A��C��D��E����Ԫ��ԭ�Ӱ뾶�Ĵ�С��˳����____________����Ԫ�ط��ţ���
��2����A��E��F���γɵĹ����ͻ������У����ȶ�����ǿ������˳����_____��
��3��A��F�γɵĻ�������A��C�γɵĻ����ﷴӦ������Ļ�ѧʽΪ_______�������д��ڵĻ�ѧ������Ϊ_______��
��4��E��F����������ˮ�����������ǿ������˳����__________��
��5��C��E�⻯���۷е�Ĵ�С��ϵ��______��
��6��F�ĵ�����D������������ˮ���ﷴӦ�����ӷ���ʽΪ__________��
��7����BC��2��Ϊ��±�أ�������±�����ƣ�������ӣ�BC��2�ĵ���ʽΪ____________����������������Һ��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
���𰸡� Na>P>N>H HCl>PH3 NH4Cl ���Ӽ������Լ� HClO4>H3PO4 NH3>PH3 Cl2+2OH-=Cl- +ClO-+H2O ![]() (CN)2+2NaOH=NaCN+NaCNO+H2O
(CN)2+2NaOH=NaCN+NaCNO+H2O
�����������ֶ�����Ԫ��A��B��C��D��E��F��ԭ��������������A��C�γɵĹ��ۻ�������ˮ�гʼ��ԣ��û�����ΪNH3����AΪHԪ�ء�CΪNԪ�أ�A��Dͬ�壬D��ԭ����������NԪ�أ���DΪNaԪ�أ�C��Eͬ�壬��EΪPԪ�أ�D��F�γɵĻ������������г�����ζ����������ΪNaCl����FΪClԪ�أ�A��B�ĺ��������֮�͵���F����������������BΪCԪ�ء�
��1��ͬ������������ԭ�Ӱ뾶��С��ͬ������ϵ���ԭ�Ӱ뾶��������A��C��D��E����Ԫ��ԭ�Ӱ뾶�Ĵ�С��˳����Na��P��N��H����2���ǽ�����Cl��P�������ȶ�����ǿ������˳����HCl��PH3����3��A��F�γɵĻ������Ȼ�����A��C�γɵĻ����ﰱ����Ӧ������Ļ�ѧʽΪNH4Cl�������д��ڵĻ�ѧ������Ϊ���Ӽ������Լ�����4���ǽ�����Cl��P����E��F����������ˮ�����������ǿ������˳����HClO4��H3PO4����5���������Ӽ���������C��E�⻯���۷е�Ĵ�С��ϵ��NH3��PH3����6��F�ĵ�����D������������ˮ���ﷴӦ�����ӷ���ʽΪCl2+2OH-=Cl- +ClO- +H2O����7����CN��2��Ϊ��±�أ�������±�����ƣ���������ӣ�CN��2�ĵ���ʽΪ![]() ����������������������Һ��Ӧ�ķ���ʽ��������������������Һ��Ӧ�Ļ�ѧ����ʽΪ(CN)2+2NaOH��NaCN+NaCNO+H2O��
����������������������Һ��Ӧ�ķ���ʽ��������������������Һ��Ӧ�Ļ�ѧ����ʽΪ(CN)2+2NaOH��NaCN+NaCNO+H2O��


 ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ȡSO2����֤SO2ijЩ���ʵ�װ��ͼ
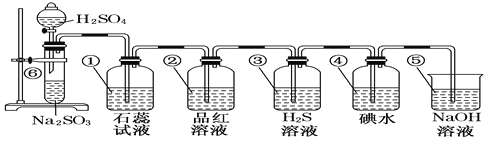
�Իش�
��1�����з�����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��2�����е�ʵ������Ϊ________________________________________________��
��3���۲쵽���е�Ʒ����Һ________��֤��SO2��________��
��4���۲쵽���е�H2S��Һ________��֤��SO2��_____________��
��5���۲쵽���еĵ�ˮ________��֤��SO2��________��
��6������NaOH��Һ��������_________���йط�Ӧ�Ļ�ѧ����ʽΪ��_________________���˷�Ӧ˵��SO2��________������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ס����ǵ绯ѧʵ��װ�ã�
��1�����ס������ձ��о�ʢ�б���NaCl��Һ���ټ���ʯī���ϵĵ缫��Ӧʽ �� ���ӵ��ƶ�����Ϊ ��
�������ܷ�Ӧ�����ӷ���ʽΪ �� Cl�������缫����Fe��C����
�۽�ʪ��ĵ��۩�KI��ֽ�������ձ��Ϸ���������ֽ�ȱ�������ɫ��������Ϊ������Cl2���������ɵ�I2 �� ����Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2�������ʼʱ����ʢ��200mL pH=5��CuSO4��Һ��25�棩��һ��ʱ�����Һ��pH��Ϊ1����Ҫʹ��Һ�ָ������ǰ��״̬��������Һ�м���CuO������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһЩ�������ʼ���ת����ϵ������FΪ����������������ijЩ���������ﷴӦ���ǹ�ҵұ�������ķ���֮һ�� AΪ��ɫ���壬BΪ����ɫ���壬CΪ��ɫҺ�壬E��JΪ��ɫ���嵥�ʣ�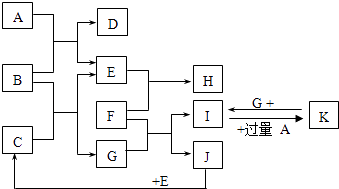
�Իش��������⣺
��1��д��B�Ļ�ѧʽ�� �� д��A�ĵ���ʽ��
��2��д��I��K�����ӷ���ʽ��
��3��д��F��Fe3O4�ڸ����·�Ӧ�Ļ�ѧ����ʽ��
��4����֪3g J��ȫȼ�շų�a kJ����������д����ʾJ��ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֬�ް�סԼ0.2g�������Ʒ�ĩ������ʯ�����ϣ�����֬���ϵ�ˮ���۲쵽��֬����ȼ��������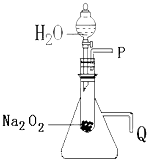
��1��������ʵ���������Ƴ��Ľ����ǣ���һ�����������ɣ��ڶ��� �� Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��2��ij�о���ѧϰС��������ͼ��ʾװ�ã����������ã�����ʵ�飬��֤���������ۣ���������֤��һ�����۵�ʵ������������ǣ�
��������֤�ڶ������۵�ʵ������������ǣ�
��3��ʵ�飨2�����Թ��м�ˮ��������ȫ�ܽ��Ҳ������������ɺ����̪��Һ��������Һ�ȱ�����ɫ��Ϊ̽����ԭ��С��ͬѧ�Ӳ����й������е�֪��Na2O2��ˮ��Ӧ������H2O2 �� H2O2����ǿ�����Ժ�Ư���ԣ��������һ���Ƕȣ���������ʹ�����ָʾ�������һ����ʵ�飬��֤Na2O2������ˮ��ַ�Ӧ�����Һ����H2O2���ڣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ���ǣ� ��
A.0.1mol��NH2���������к��еĵ�����ĿΪ1.0NA
B.�����£�1L 0.1molL��1 CH3COONa��Һ�к��е�CH3COO����Na+����Ϊ0.2NA
C.��״���£�2.24 LH2O�к��е�ԭ������Ϊ3NA
D.���³�ѹ�£�16 g O2��O3������庬�е���ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��g��+B��g��C��g��+D��s����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶ȡ� | 700 | 800 | 880 | 1000 | 1200 |
ƽ�ⳣ�� | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H0�������������=������
��2��800��ʱ����һ��5L���ܱ������г���0.4molA��0.7molB������Ӧ��ʼ2mim��A��ƽ����Ӧ����Ϊ0.01molL��1min��1 �� ��2minʱc��A��=molL��1 �� C�����ʵ���Ϊmol��������һ��ʱ���Ӧ�ﵽƽ��ʱ���������г���0.4molA�����ٴδﵽƽ���A�İٷֺ������һ��ƽ����������������С�������䡱��
��3������ѡ��������Ϊ�жϷ�Ӧ�ﵽƽ��������� a��ѹǿ����ʱ��ı�
b��v��A����v��b��=1��1
c����λʱ��������A��B�����ʵ������
d��C�İٷֺ������ֲ���
��4��880�� ʱ����Ӧ C��g��+D��s��A��g��+B��g����ƽ�ⳣ����ֵΪ ��
��5��ij�¶�ʱ��ƽ��Ũ�ȷ�����ʽ��c��A����c��B��=c��C������ô�ʱ���¶�Ϊ�森
��6��ͼ��1000��ʱ������A�����ʵ����ı仯���ߣ�����ͼ�в������÷�Ӧ��1200��ʱA�����ʵ����ı仯����ͼ �� 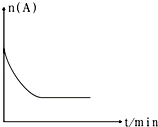
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ʹ�������������Һ��ɫ���ǣ� ��
A.��Ȳ
B.�ױ�
C.��
D.��ϩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com