
I. NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
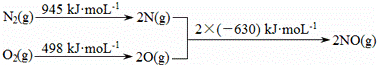
则1mol氮气完全反应转化为一氧化氮 _ (填“吸收”或“放出”)的热量是_____________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 。
(4) 通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
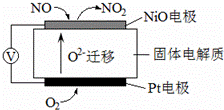
①Pt电极上发生的是____ 还原反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:____ 。NO+O2--2e-=NO2
3NO2+H2O=2HNO3+NO
科目:高中化学 来源: 题型:
.在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g) +CO2(g)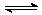 CO(NH2)2 (l)+H2O(l).
CO(NH2)2 (l)+H2O(l).
① 已知该反应的平衡常数K195℃ < K165℃,则该反应的△H_______0(填“>”“=”或“<”)。
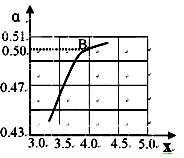
② 一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)/ n(CO2)=x,右图是氨碳比(x)与CO2平衡转化率(a)的关系。a随着x增大的原因是________。
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容
下充入气体He,CO(NH2)2(l)的质量_____(填“增加”、“减小”或“不变”)。
Ⅱ:(1)某温度下,纯水中c(H+) = 2.0×10-7mol/L,该温度下,0.9mol/L NaOH
溶液与0.1 mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的
pH=_________。
(2)向100 mL 0.10 mol/L CH3COOH的溶液中加入0.010 mol CH3COONa固体,溶
液pH增大,主要原因是(请用学过的平衡理论解释)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 |
|
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气 | 铁丝表面灰暗程度比 |
下列有关说法不正确的是( )
A.上述实验中已明显发生电化学腐蚀的实验是3、4、5、6
B.影响金属腐蚀的外部因素有湿度、温度、O2的浓度、电解质等
C.实验6中铁被腐蚀的程度比5严重是因铁发生了如下反应:Fe-2e-===Fe2+
D.若保持铁表面干燥或将锌与铁相连,可 起到保护铁制品的作用
起到保护铁制品的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C2H4(g)和C2H5OH(1)的燃烧热分别是1411.0kJ·mol-1和1366.8kJ mol-1,则由C2H4(g)和H2O (l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )


A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
根据右图实验装置判断,下列说法正确的是
A.该装置能将电能转化为化学能
B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑
C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3


查看答案和解析>>
科目:高中化学 来源: 题型:
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)  2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
 A.相同温度下新平衡时容器中的压强是原平衡时的两倍
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。
(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100mL 0.01 mol ·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2 的产量,可以使用如下方法中的
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1 mol ·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.⑤⑥⑧ D.③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com