
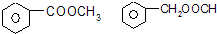 .
.分析 A分子中含碳的质量分数为70.6%、氢的质量分数为5.9%,则A分子中含有O的质量分数为:1-70.6%-5.9%=23.5%,则A分子中N(C)=$\frac{136×70.6%}{12}$=8、N(H)=$\frac{136×5.9%}{1}$=8,则分子中N(O)=$\frac{136-12×8-8}{16}$=2,A的分子式为C8H8O2,不饱和度=$\frac{2×8+2-8}{2}$=5,A的分子中含有苯环,若A能与NaHCO3溶液反应放出CO2气体,分子中应含有羧基,可为苯乙酸、甲基苯甲酸等;若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,说明分子中含有酯基,可为苯甲酸甲酯或甲酸苯甲酯等,若A与NaOH溶液在加热时才能反应,且1molA消耗2molNaOH,A存在羧酸与酚形成的酯基,取代基为-OOCCH3,或者-CH3、-OOCH,有邻、间、对.
解答 解:(1)A分子中含碳的质量分数为70.6%、氢的质量分数为5.9%,则A分子中含有O的质量分数为:1-70.6%-5.9%=23.5%,则A分子中N(C)=$\frac{136×70.6%}{12}$=8、N(H)=$\frac{136×5.9%}{1}$=8,则分子中N(O)=$\frac{136-12×8-8}{16}$=2,A的分子式为C8H8O2,
故答案为:C8H8O2;
(2)A的不饱和度=$\frac{2×8+2-8}{2}$=5,A的分子中含有苯环,若A能与NaHCO3溶液反应放出CO2气体,分子中应含有羧基,可为苯乙酸、甲基苯甲酸,其中甲基苯甲酸有邻、间、对3种,共4种,
故答案为:4;
(3)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,说明分子中含有酯基,可为苯甲酸甲酯或甲酸苯甲酯等,结构简式为: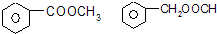 ,
,
故答案为: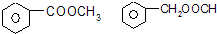 ;
;
(4)若A与NaOH溶液在加热时才能反应,且1molA消耗2molNaOH,A存在羧酸与酚形成的酯基,可以是 、
、 ,共有4种,
,共有4种,
故答案为:4.
点评 本题考查有机物的推断,题目难度适中,侧重于学生分析计算能力的考查,注意熟练掌握常见有机物结构与性质.


科目:高中化学 来源: 题型:选择题
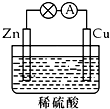
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取铝 | |
| C. | 铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物 | |
| D. | Na2O2、NaOH、NH4Cl均为含共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
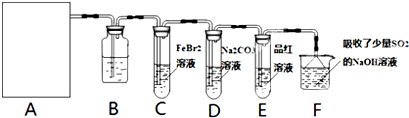
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
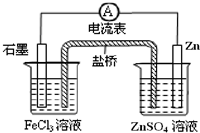 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D的最简式CH2;
;D的最简式CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第I A族元素都是碱金属元素 | |
| B. | 元素周期表中有18个纵行,所以有18个族 | |
| C. | 可以从过渡金属中寻找新型催化剂 | |
| D. | 主族元素的金属元素原子最外层电子数一定小于或等于4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com