
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率。
请回答下列问题:
(1)氢写出Ti原子的核外电子排布式______。
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行,反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(1)1s22s22p63s23p63d24s2 (2分)
(2)2FeTiO3 + 6C + 7Cl2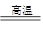 2FeCl3 + 2TiCl4 + 6CO (2分)
2FeCl3 + 2TiCl4 + 6CO (2分)
(3)TiCl4 + (2+x)H2O TiO2·xH2O↓+ 4HCl △H﹥0加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全。(3分)
TiO2·xH2O↓+ 4HCl △H﹥0加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全。(3分)
(4)1412 (2分)
(5)2CH3OH(l)+ 3O2(g)=2CO2(g)+ 4H2O(l) △H=-1453kJ·mol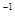 (2分)
(2分)
CH3OH + 3CO32- - 6e- = 4CO2 + 2H2O (2分) 7.5 (3分)
解析试题分析:(1)Ti的原子序数为22,原子核外电子排布为1s22s22p63s23p63d24s2 ,故处于第四周期第ⅣB族;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3 + 6C + 7Cl2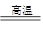 2FeCl3 + 2TiCl4 + 6CO ;
2FeCl3 + 2TiCl4 + 6CO ;
发生TiCl4 + (2+x)H2O TiO2·xH2O↓+ 4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
TiO2·xH2O↓+ 4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
(4)在Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃;
(5)根据燃烧热的定义:在25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,C转化为二氧化碳,H转化为液态水.故可以得出CH3OH完全燃烧的热化学方程式;2CH3OH(l)+ 3O2(g)=2CO2(g)+ 4H2O(l) △H=-1453kJ·mol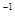 ;以甲醇和氧气(或空气)、电解液为Li2CO3和K2CO3的熔融物组成燃料电池,在电池工作时,CO32-移向负极。CH3OH在负极上失去电子,在CO32-的作用下生成CO2气体,O2在正极上得到电子,在CO2的作用下生成CO32-,其电极反应式为
;以甲醇和氧气(或空气)、电解液为Li2CO3和K2CO3的熔融物组成燃料电池,在电池工作时,CO32-移向负极。CH3OH在负极上失去电子,在CO32-的作用下生成CO2气体,O2在正极上得到电子,在CO2的作用下生成CO32-,其电极反应式为
负极:CH3OH-6e-+3CO32-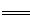 4CO2↑+2H2O
4CO2↑+2H2O
正极: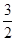 O2+6e-+3CO2
O2+6e-+3CO2 3CO32-
3CO32-
由CO(g)+2H2(g)=CH3OH(g)可知,合成9mol甲醇需要n(CO)=9mol、n(H2)=18mol.根据2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=
2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=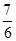 n(CO)=
n(CO)=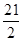 mol,根据2NaCl+2H2O
mol,根据2NaCl+2H2O  2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=
2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=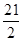 mol,故需额外补充H2为18mol-
mol,故需额外补充H2为18mol-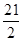 mol=7.5mol。
mol=7.5mol。
考点:化学工艺流程题目。


科目:高中化学 来源: 题型:填空题
海洋是个巨大的资源宝库,海水资源的利用具有非常广阔的发展前景。海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下所示:
(1)步骤①反应的廊子方程式为_______________________________。
(2)步骤③反应的化学方程式为_________________________________。
(3)Br的原子序数是________,在周期表中位于第________周期、________族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________。
(5)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏,得出液溴?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):_______________________________________________。
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式: ______________ ______________________________________________。
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是________(单选)。
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1 nm=10-10m |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
(6)检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
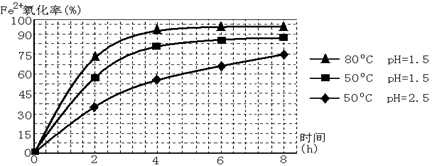
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用 (填序号)
| A.空气 | B.Cl2 | C.MnO2 | D.H2O2, |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、 Mg2+、 Ca2+、Cu2+等)制备氯化锌的一种流程如下:
(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(6分)(2012?重庆)化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关生铁炼钢的叙述错误的是( )。
| A.添加必要的元素,改善钢材的组织结构和性能 |
| B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质 |
| C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧 |
| D.除去生铁中的非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com