
(6分)(2012?重庆)化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
D
解析试题分析:化学变化是指在原子核不变的情况下,有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成.
解:A.N2和H2合成NH3发生了化学变化,故A错误;
B.钢铁厂炼铁的原理是用还原剂将铁从其氧化物中还原出来,发生的是化学变化,故B错误;
C.接触法制硫酸发生的三个反应是S+O2 SO2、2SO2+O2
SO2、2SO2+O2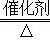 2SO3、SO3+H2O═H2SO4,发生了化学变化,故C错误;
2SO3、SO3+H2O═H2SO4,发生了化学变化,故C错误;
D.炼油厂用分馏法生产汽油是利用沸点的不同进行混合物的分离操作,发生的是物理变化,故D正确.
故选D.
点评:本题主要考查了物理变化和化学变化的区别,题目难度不,可以依据化学变化的实质进行.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率。
请回答下列问题:
(1)氢写出Ti原子的核外电子排布式______。
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行,反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
(1)C1O2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________
A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________(填选项字母)。
A.二氧化氯可广泛用于工业和饮用水处理
B.二氧化氯应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和检测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为________。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为________此法相比欧洲方法的优点是________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为________。此法提高了生产及储存、运输的安全性,原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(1)下列化肥属于氮肥的是__________。
| A.NH4Cl | B.KCl | C.(NH4)2SO4 | D.K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某地农田土壤胶体的胶粒带负电荷,若在该农田里施加含氮量相等的下列化肥,有效成分利用率最差的是( )
| A.(NH4)2SO4 | B.NH4HCO3 | C.NH4NO3 | D.NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨时既要使氨的产率增大,又要使反应速率加快,可采取的办法是( )。
①减压 ②加压 ③升温 ④降温⑤及时从平衡混合气中分离出NH3
⑥补充N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
| A.③④⑤⑦ | B.①②⑤⑥ | C.②⑥ | D.②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了进一步提高合成氨的生产效率,科研中具有开发价值的是 ( )。
| A.研制高温下活性较大的催化剂 |
| B.寻求NH3的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温高压的新型材料建造合成塔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com