
【题目】为了更简便地制取干燥的NH3 , 适合的方法是( )
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2 ![]() 2NH3 , 用烧碱进行干燥
2NH3 , 用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3 , 气体用P2O5干燥
【答案】C
【解析】解:A.NH4Cl和H2SO4(浓)混合加热得不到大量氨气,不能用来实验室制备,故A错误;B.N2与H2反应生成氨气需要高温高压催化剂条件,且此反应是可逆反应,反应条件复杂,得到的产物不纯净,在实验室中不能实现,故B错误;
C.浓氨水具有挥发性,加热能够促进氨气的挥发,氨气为碱性气体,应选择碱性干燥剂干燥,可以用碱石灰干燥,故C正确;
D.硝酸铵受热容易发生爆炸,不能用来制备氨气,P2O5也不可用来干燥氨气,故D错误;
故选C.
【考点精析】利用氨的化学性质和氨的实验室制法对题目进行判断即可得到答案,需要熟知与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
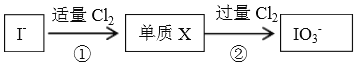
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ![]() ):n(
):n( ![]() )变化的关系如表:
)变化的关系如表:
n( | 91:9 | 1:1 | 9:91 |
Ph | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中c(H+)<c(OH﹣)
B.Na2SO3溶液中c(Na+)>c (SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO ![]() )+c(SO
)+c(SO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( ) 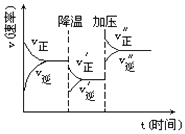
A.降温后逆反应速率增大
B.逆反应是放热反应
C.A,B,C,D均为气体
D.若A,B是气体,则D是液体或固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,把气体缓慢通入盛有足量试剂的试剂瓶A和试管B,在试管B中不能观察到明显现象的是( )
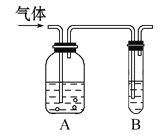
选项 | 气体 | A中试剂 | B中试剂 |
A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
B | Cl2、HCl | 饱和NaCl溶液 | KI淀粉溶液 |
C | CO2、HCl | 饱和NaHCO3溶液 | NaAlO2溶液 |
D | NH3、CO2 | 浓硫酸 | 酚酞试液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2= , 反应 ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g) ![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数K3= .
H2O(g)的平衡常数K3= .
(3)已知在1 000℃时,该反应的平衡常数K4为1.0,则该反应为反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正)v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体 ⑤pH试纸的使用
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均已略去。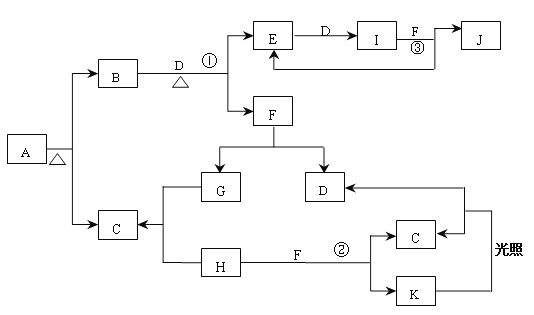
(1)写出它们的化学式:A__________、C___________、J____________;
(2)实验室制备气体B的化学方程式为:___________________________________。
(3)写出B+D→E+F 的化学方程式:__________________________________________。
(4)J的浓溶液与单质Cu反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:①称量②计算③溶解④倒转摇匀⑤转移⑥洗涤⑦定容⑧冷却。
其正确的操作顺序为___________ ⑤⑥⑤__________。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、胶头滴管、还有_____________________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为_________ g。要完成本实验该同学应称出_________ g NaOH。

(3)对所配制的NaOH溶液进行测定,发现其浓度低于1.0mol/L。在溶液配制过程中,下列操作会引起该误差的有_________(填序号)。
A.转移溶解的溶液后没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶未干燥就用来配制溶液
D.称量NaOH固体时动作太慢,耗时太长
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平
F.定容时仰视刻度线
G.NaOH固体溶解后未经冷却即转移到容量瓶中
(4)氢氧化钠是一种用途十分广泛的重要化工原料,工业上主要通过电解氯化钠饱和溶液的方法![]() 。试用单线桥法标出该反应中电子转移的方向和数目____________________。实验测得,反应中生成的气体在标准状况下的体积为4.48L,则耗氧化剂的物质的量为_________mol。
。试用单线桥法标出该反应中电子转移的方向和数目____________________。实验测得,反应中生成的气体在标准状况下的体积为4.48L,则耗氧化剂的物质的量为_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com