
【题目】已知A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均已略去。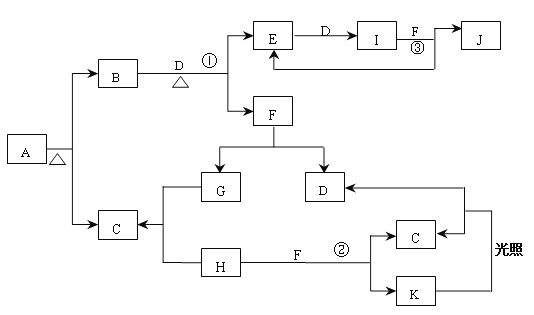
(1)写出它们的化学式:A__________、C___________、J____________;
(2)实验室制备气体B的化学方程式为:___________________________________。
(3)写出B+D→E+F 的化学方程式:__________________________________________。
(4)J的浓溶液与单质Cu反应的离子方程式为__________________________________。
【答案】 NH4Cl HCl HNO3 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O 4NH3+5O2
CaCl2+2NH3↑+2H2O 4NH3+5O2  4NO+6H2O Cu+4H++2NO3-= Cu2++2NO2↑+2H2O
4NO+6H2O Cu+4H++2NO3-= Cu2++2NO2↑+2H2O
【解析】试题分析:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,则B为氨气;气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,则E为一氧化氮、I为二氧化氮、D为氧气;F在常温下是一种无色液体,则F为水、J为硝酸、G为氢气;H为黄绿色气体,则H为氯气、C为氯化氢、A为氯化铵。C、J的水溶液分别为两种强酸——盐酸和硝酸。
(1)A 的化学式为NH4Cl、C的化学式为HCl 、J的化学式为HNO3;
(2)实验室制备气体B的化学方程式为为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3)写出B+D→E+F 的化学方程式为4NH3+5O2  4NO+6H2O。
4NO+6H2O。
(4)J的浓溶液与单质Cu反应的离子方程式为Cu+4H++2NO3-= Cu2++2NO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】工业上炼铁的主要反应为:Fe2O3 + 3CO![]() 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)该反应中氧化剂是______(填化学式),判断依据是________;被氧化的物质是____(填化学式);若反应中消耗了3 mol CO,则生成______mol Fe。
(2)理论上来看,其中CO可用以下______组(选填a、b、c)物质代替,这些物质在反应中的作用都是_______。
a组: H2 、Cl2 、C b组: H2 、Al、C c组:C 、Al、 Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便地制取干燥的NH3 , 适合的方法是( )
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2 ![]() 2NH3 , 用烧碱进行干燥
2NH3 , 用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3 , 气体用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的主要成分对应正确的是
A | B | C | D | |
物质 | 加碘食盐 | 漂粉精 | 食用纯碱 | 铝热剂 |
主要成分 | NaCl I2 | CaCl2 Ca(ClO)2 | NaHCO3 | Al2O3 Fe |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 107 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是( )
A. 蒸馏法B. 升华法C. 萃取法D. 过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 ![]() 2SO3 , 的说法不正确的是( )
2SO3 , 的说法不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2molSO2和1molO2 , 则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3 :Si + 3HCl(g)![]() SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g) + H2(g)![]() Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是 。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应X(g)+3Y(g)2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) 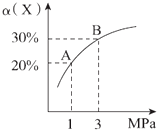
A.图中A,B两点,达到相同的平衡体系
B.上述反应在达到平衡后,增大压强,H2的转化率提高
C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D.将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com