
【题目】在一定条件下,反应X(g)+3Y(g)2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) 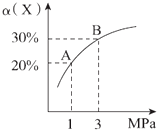
A.图中A,B两点,达到相同的平衡体系
B.上述反应在达到平衡后,增大压强,H2的转化率提高
C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D.将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
【答案】B
【解析】解:A、图中A、B两点,X的平衡转化率(α)不同,两者为不相同的平衡体系,故A错误;B、增大压强平衡向体积减小的方向移动,即向正反应移动,X的转化率提高,故B正确;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动,故C错误;
D、热化学方程式X(g)+3Y(g)2Z(g)△H=﹣92.4kJ/mol表示1molX(g)和3molY(g)完全反应生成2molZ(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故D错误;
故选B.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】已知A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均已略去。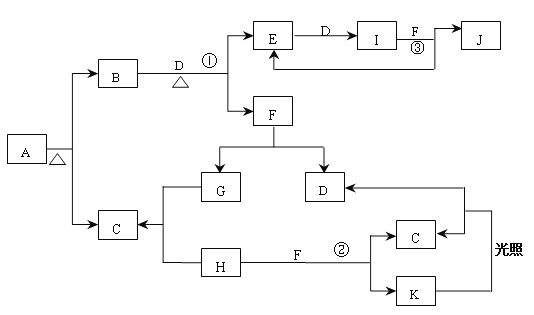
(1)写出它们的化学式:A__________、C___________、J____________;
(2)实验室制备气体B的化学方程式为:___________________________________。
(3)写出B+D→E+F 的化学方程式:__________________________________________。
(4)J的浓溶液与单质Cu反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:①称量②计算③溶解④倒转摇匀⑤转移⑥洗涤⑦定容⑧冷却。
其正确的操作顺序为___________ ⑤⑥⑤__________。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、胶头滴管、还有_____________________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为_________ g。要完成本实验该同学应称出_________ g NaOH。

(3)对所配制的NaOH溶液进行测定,发现其浓度低于1.0mol/L。在溶液配制过程中,下列操作会引起该误差的有_________(填序号)。
A.转移溶解的溶液后没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶未干燥就用来配制溶液
D.称量NaOH固体时动作太慢,耗时太长
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平
F.定容时仰视刻度线
G.NaOH固体溶解后未经冷却即转移到容量瓶中
(4)氢氧化钠是一种用途十分广泛的重要化工原料,工业上主要通过电解氯化钠饱和溶液的方法![]() 。试用单线桥法标出该反应中电子转移的方向和数目____________________。实验测得,反应中生成的气体在标准状况下的体积为4.48L,则耗氧化剂的物质的量为_________mol。
。试用单线桥法标出该反应中电子转移的方向和数目____________________。实验测得,反应中生成的气体在标准状况下的体积为4.48L,则耗氧化剂的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5molL﹣1 , 下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5molL﹣1 , 下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50molL﹣1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每摩尔物质含有( )。
A. 6.02×1023个分子B. 6.02×1023个原子
C. 阿伏加德罗常数个原子D. 阿伏加德罗常数个该物质的粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4mol SO2和3mol O2 一定条件下建立平衡2SO2(g)+O2(g)═2SO3(g)△H=﹣Q KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q KJ
B.2Q KJ
C.Q KJ
D.0.9Q KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属的合金13 g,与足量稀硫酸反应后,在标准状况下产生气体11.2 L,则组成该合金的金属不可能是( )
A.Mg和Al
B.Mg和Zn
C.Al和Zn
D.Al和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在学习中具有重要的作用。下列关于实验的叙述中正确的有 ____________。
A.不慎碰翻燃着的酒精灯失火,应立即用湿布灭火
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH清洗
C.用托盘天平称量物品质量时,物品应置于右盘
D.实验时应节约药品,实验剩余的药品应放回原试剂瓶
E.可燃性气体点燃前一定要验纯
F.使用分液漏斗前须检查其是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题. 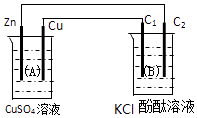
(1)锌极为极,电极反应式为:;
石墨棒C1为极,电极反应式为:;
石墨棒C2附近观察到的实验现象为;
(2)当C2极析出224mL气体(标准状态)时,锌的质量减小g,A池中溶液的质量变化(填增大、不变或减小)g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com