
【题目】某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1molL﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示: 
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是 .
②t时间段内,造成其pH发生上述变化,用离子方程式解释是 .
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况: 实验ⅰ
装置 | 操作 | 现象 |
| 向2mL1molL﹣1FeCl3溶液中,逐滴滴加1moL﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
实验ⅱ
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是 .
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色. ①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是 .
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是 .
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是 .
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是 .
【答案】
(1)SO32﹣+H2O?HSO3﹣+OH﹣;2SO32﹣+O2=2SO42﹣
(2)SO42﹣;SO32﹣+2Fe3++H2O=SO42﹣+2Fe2++2H+
(3)4Fe2++O2+4H+=4Fe3++2H2O;O2>Fe3+>SO42﹣;8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl;Fe3++3H2O?Fe(OH)3(胶体)+3H+
【解析】解:(1)①亚硫酸氢根水解导致溶液呈碱性,故离子方程式为SO32﹣+H2OHSO3﹣+OH﹣ , 所以答案是:SO32﹣+H2OHSO3﹣+OH﹣;②t时间段内,造成其pH发生上述变化原因是亚硫酸跟离子不稳定,极易被空气中氧气氧化,故离子方程式为2SO32﹣+O2=2SO42﹣ , 所以答案是:2SO32﹣+O2=2SO42﹣;(2)①由实验ⅱ滴加BaCl2溶液产生白色沉淀,故实验ⅱ证明,溶液中含有SO42﹣离子, 所以答案是:SO42﹣;②认识Ⅰ.SO32﹣与Fe3+和H2O反应生成SO42﹣和Fe2+和H+ , 故离子方程式为SO32﹣+2Fe3++H2O=SO42﹣+2Fe2++2H+ , 所以答案是:SO32﹣+2Fe3++H2O=SO42﹣+2Fe2++2H+;(3)①c(Fe2+)极小,其原因是易被空气中氧气氧化,故对应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,所以答案是:4Fe2++O2+4H+=4Fe3++2H2O;
②实验ⅰ中发生SO32﹣+2Fe3++H2O=SO42﹣+2Fe2++2H+ , c(Fe2+)极小,其原因是易被空气中氧气氧化,故对应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,由氧化剂的氧化性大于氧化产物的氧化性可知氧化性为O2>Fe3+>SO42﹣ , 所以答案是:O2>Fe3+>SO42﹣;③FeCl3和Na2SO3、O2、H2O反应生成Fe4(OH)2(SO4)5和NaCl和HCl,故化学方程式为8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl,所以答案是:8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl;④Fe3+水解生成Fe(OH)3(胶体),故离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+ , 所以答案是:Fe3++3H2OFe(OH)3(胶体)+3H+ .


科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是( )
A.煤井中的瓦斯气和家庭使用的液化石油气的主要成分都是甲烷
B.苯的结构简式为 ![]() ,分子式可简化为CH
,分子式可简化为CH
C.利用酸性KMnO4溶液可鉴别乙烯和乙烷
D.苯与乙烯均能与溴水发生加成反应,而甲烷只能与溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、CO32-、SO42-、OH- , 现取三份各100 mL的溶液进行如下实验(每步实验均仅进行完全),根据实验内容填写相应结论:
(1)第一份加足量NaOH溶液加热后,收集到0.68gNH3气体,原溶液中一定不含有;
(2)第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
综合以上实验,原溶液中一定含有、 , 一定不含有;
(3)第三份加入AgNO3溶液有沉淀产生。
原溶液中还一定存在 , 可能存在(若没有,两空均可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知B为黑色粉末,用D,E,G做焰色反应实验,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图1所示. 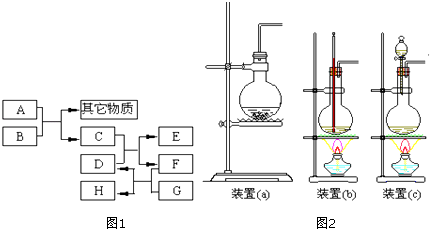
(1)请根据以上关系进行判断,指出下列物质的化学式:
A , C , D , G .
(2)写出下列反应的化学方程式:C+D:;A+B: .
在A和B的反应中,A显示出来的性质是(填写序号,多选倒扣).
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
当A和B进行反应时,应选择图2所示装置中的较为合适.
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,滴加同一新制氯水.其导电能力随氯水体积变化的曲线如图所示(不考虑空气的影响).下列分析正确的是( ) 
A.曲线a代表H2SO3溶液
B.曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3﹣)+c(SO32﹣)+c(SO42﹣)
C.曲线a、b、c代表的溶液中均始终保持:2c(Cl﹣)=c(SO42﹣)
D.当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答: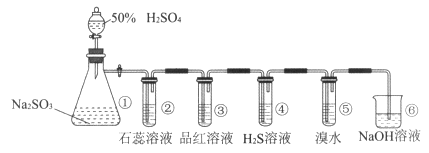
(1)①中发生反应的离子方程式是。
(2)②中的实验现象是。
(3)③的实验现象是 , 证明SO2有性。
(4)④中SO2做剂。
(5)⑤中反应生成两种强酸,该反应的离子方程式是 , 当1 molSO2参与反应时,转移电子的物质的量是。
(6)⑥的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.碳酸钙和盐酸反应:CO32﹣+2H+═CO2↑+H2O
B.过量的氯化铁和锌反应,锌溶解:2Fe3++Zn═2Fe2++Zn2+
C.醋酸和苯酚钠溶液的反应: ![]() O﹣+CH3COOH→
O﹣+CH3COOH→ ![]() OH↓+CH3COO﹣
OH↓+CH3COO﹣
D.碳酸氢钠溶液与氯化铝溶液反应:Al3++3HCO3﹣═Al(HCO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机中生成NO的反应为:N2(g)+O2(g)2NO(g),t℃时,K=0.09.在t℃下甲、乙、丙三个恒容密闭容器中,投入N2(g)和 O2(g)模拟反应,起始浓度如表所示.下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/molL﹣1 | 0.46 | 0.46 | 0.92 |
c(O2)/molL﹣1 | 0.46 | 0.23 | 0.92 |
A.起始时,反应速率:丙>甲>乙
B.平衡时,c(NO):甲=丙>乙
C.平衡时,N2的转化率:甲>乙
D.平衡时,甲中c(N2)=0.4 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.2molO3和0.3molO2的质量(选填“相等”、“不相等”或“无法判断”),分子数之比为 , 所含原子数之比为 , 在相同条件下的体积之比为。
(2)73gHCl气体中含有个分子,标准状况下占有的体积为L。
(3)相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl的沉淀的质量之比为3:2:1时,三种溶液的体积比为。
(4)标准状况下VL氯化氢气体溶解在1L水中,所得溶液的密度为ρgmL,溶液中溶质的质量分数为ω,物质的量浓度为cmolL-1 , 则ω=(任写一种表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com