
【题目】已知B为黑色粉末,用D,E,G做焰色反应实验,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图1所示. 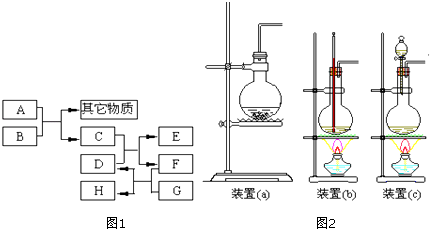
(1)请根据以上关系进行判断,指出下列物质的化学式:
A , C , D , G .
(2)写出下列反应的化学方程式:C+D:;A+B: .
在A和B的反应中,A显示出来的性质是(填写序号,多选倒扣).
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
当A和B进行反应时,应选择图2所示装置中的较为合适.
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 .
【答案】
(1)HCl;Cl2;KBr;KI
(2)Cl2+2KRr=2KCl+Br2;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;②;c
MnCl2+Cl2↑+2H2O;②;c
(3)5:1
【解析】解:D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,则均含K元素,B为黑色粉末,则B为MnO2 , A应为浓盐酸,则C为Cl2 , F为深红棕色液体,H能使淀粉变蓝,F为Br2 , H为I2 , 则D为KBr,E为KCl,G为KI,符合上述转化,(1)由上述分析可知,A为HCl,C为Cl2 , D为KBr,G为KI,所以答案是:HCl;Cl2;KBr;KI;(2)C+D的反应为Cl2+2KRr=2KCl+Br2 , A+B的反应为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,该反应生成氯化锰体现盐酸的酸性,生成氯气体现盐酸的还原性,②符合,该反应为固体和液体反应需要加热,所以用c装置,所以答案是:Cl2+2KRr=2KCl+Br2;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,该反应生成氯化锰体现盐酸的酸性,生成氯气体现盐酸的还原性,②符合,该反应为固体和液体反应需要加热,所以用c装置,所以答案是:Cl2+2KRr=2KCl+Br2;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;②;c;(3)KClO3+6HCl=KCl+3Cl2↑+3H2O中,Cl元素的化合价由﹣1价升高为0,失去电子被氧化,5molHCl作还原剂;Cl元素的化合价由+5价降低为0,得到电子被还原,1molKClO3作氧化剂,由电子守恒可知,被氧化的氯元素与被还原的氯元素的物质的量之比为5:1,所以答案是:5:1.
MnCl2+Cl2↑+2H2O;②;c;(3)KClO3+6HCl=KCl+3Cl2↑+3H2O中,Cl元素的化合价由﹣1价升高为0,失去电子被氧化,5molHCl作还原剂;Cl元素的化合价由+5价降低为0,得到电子被还原,1molKClO3作氧化剂,由电子守恒可知,被氧化的氯元素与被还原的氯元素的物质的量之比为5:1,所以答案是:5:1.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,已知氯化锰可溶于水,二氧化锰难溶于水,能达到实验目的的是:( )
A.用装置甲制取氯气
B.用装置乙吸收实验过程中制取的多余的氯气
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁除去氯气中的少量氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某品牌牙膏中摩擦剂的成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。利用下图所示装置(夹持仪器略去),对该牙膏样品中碳酸钙的含量进行定量测定。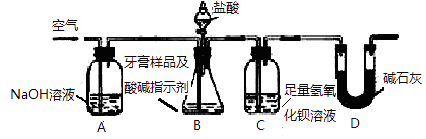
(1)C中反应生成BaCO3的化学方程式是
(2)装置D的作用是
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)下列各项措施中,不能提高测定准确度的是(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A→B之间增添盛有浓硫酸的洗气装置
d.在B→C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)硅酸钠的水溶液俗称 , 向碳酸氢钠溶液中滴入1~2滴酚酞溶液,溶液显色。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为。
(3)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,以防止发生反应:(离子方程式)。
(4)将Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无残留金属存在,请用两个化学反应方程式表示其变化:
①。
②。
(5)已知:5NH4NO3 ![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组试利用废铝屑(含杂质铁)制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其主要实验流程如下:
(1)向溶液A中通入过量的CO2 , 发生反应的离子方程式为 。
(2)操作II所包含的实验操作的名称依次为 、冷却结晶、、洗涤、干燥。
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为 。
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重%= ![]() ×100%
×100%
则失重第一阶段的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N 、Na、Mg、Al、Fe、Si等元素,是人类未来的资源宝库,按要求填空。
(1)Na+结构示意图 , 在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是 , 所形成的氧化物中适宜做耐火材料的元素是;
(2)月球上某矿石经处理得到的MgO中含有SiO2 , 除去SiO2的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1molL﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示: 
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是 .
②t时间段内,造成其pH发生上述变化,用离子方程式解释是 .
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况: 实验ⅰ
装置 | 操作 | 现象 |
| 向2mL1molL﹣1FeCl3溶液中,逐滴滴加1moL﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
实验ⅱ
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是 .
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色. ①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是 .
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是 .
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是 .
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不合理的是 ( )
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.制备FeC13溶液时,先将固体溶于较浓盐酸,再加水稀释
D.用干燥的pH试纸测量某酸溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用托盘天平称量食盐,将食盐放在右盘,砝码放在左盘,称得食盐的质量为15.5 g(1 g以下用游码)。该学生所称量的食盐的实际质量是( )
A. 15.5 g B. 15.0 g C. 14.5 g D. 16.0 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com