
《化学与技术》模块(选考题)
普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F
B.Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4
D.CaHPO4和Ca(H2PO4)2
科目:高中化学 来源: 题型:
从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来___________________________________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)====6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)====P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)====CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=_____________________________。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为________________________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为___________________________。

(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________________________。
②化学镀镍的溶液中含有Ni2+和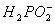 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)__________Ni2++__________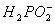 +__________
+__________ __________Ni+________
__________Ni+________ +_______
+_______
(b)6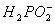 +2H+====2P+4
+2H+====2P+4 +3H2↑
+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:_______________;原理上的相同点:_______________;化学镀的优点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以黄铁矿为原料生产硫酸的工艺流程图如下:
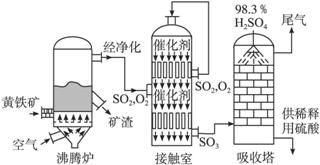
(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Cl、N、S等非金属元素化合物的说法正确的是…( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于滴定操作的叙述,正确的是( )
A.若滴定管中液面在20.00 mL处,则液体全部流出时所得液体体积为20.00 mL
B.用标准NaOH溶液滴定CH3COOH溶液时,可选用甲基橙为指示剂
C.用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高
D.滴定时可将KMnO4溶液装在碱式滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y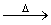 Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
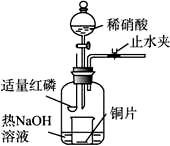
①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ______________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
____________________________________________________________________。
反应的离子方程式是____________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
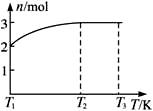
①温度在T1~T2之间,反应的化学方程式是_________________________。
②温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为: SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):
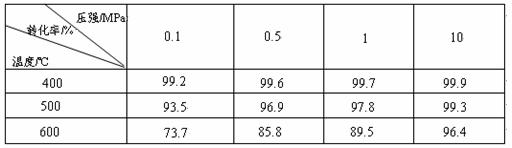
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com