
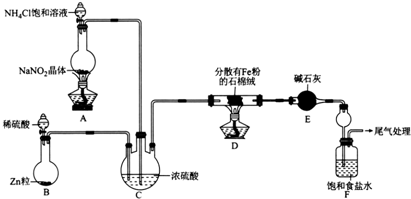
分析 (1)根据装置图可以知道装置E中盛放碱石灰的仪器名称;
(2)根据图示,装置A的作用是制备氮气,氯化铵和亚硝酸钠之间反应产生氮气;
(3)装置D中氮气和氢气按照一定的比例混合可以得到氨气,装置C的作用为使N2和H2混合均匀、干燥氮气和氢气、通过气泡的溢出速率控制氮气和氢气的混合比例;
(4)加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性、氢气和氧气混合加热爆炸,氢气可以做保护气,点燃之前要验纯;
(5)饱和氯化钠可以吸收氨气,得到碱性溶液,该溶液可以吸收二氧化碳气体,得到溶解度较小的碳酸氢钠晶体;
(6)根据溶度积常数的意义,知道先生成的是AgCl,再生成砖红色的铬酸银,可以确定滴定终点的现象;氯化铵饱和溶液的物质的量浓度是2mol/L×0.026L÷0.01L=5.2mol/L.
解答 解:(1)根据装置图可以知道装置E中盛放碱石灰的仪器名称为干燥管,故答案为:干燥管;
(2)根据图示,装置A的作用是制备氮气,氯化铵和亚硝酸钠之间的反应为:NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O,故答案为:NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(3)装置D中氮气和氢气按照一定的比例混合可以得到氨气,装置C的作用为使N2和H2混合均匀、干燥氮气和氢气、通过气泡的溢出速率控制氮气和氢气的混合比例,故答案为:干燥氮气和氢气;通过气泡的溢出速率控制氮气和氢气的混合比例;
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,这样不但防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性,还可以防止氢气和氧气混合加热爆炸,故答案为:防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性;防止氢气和氧气混合加热爆炸;
(5)饱和氯化钠可以吸收氨气,得到碱性溶液,该溶液可以吸收二氧化碳气体,得到溶解度较小的碳酸氢钠晶体,即Na++CO2+NH3+H2O=NH4++NaHCO3;
故答案为:白色的晶体析出;Na++CO2+NH3+H2O=NH4++NaHCO3;
(6)根据溶度积常数的意义,知道先生成的是AgCl,再生成砖红色的铬酸银,可以确定滴定终点的现象是:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失,氯化铵饱和溶液的物质的量浓度是2mol/L×0.026L÷0.01L=5.2mol/L,故答案为:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失;5.2mol/L.
点评 本题是一道考查侯氏制碱法原理的实验方案设计题,注重元素化合物性质的考查,难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:实验题
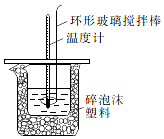 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡时NH3的 物质的量mol |
| T1 | 1.2 |
| T2 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
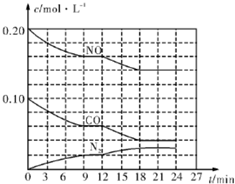 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
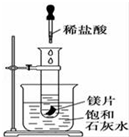 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向甲容器中再充人一定量的氦气 | B. | 向乙容器中再充人2mol的SO3气体 | ||
| C. | 适当降低乙容器的温度 | D. | 缩小甲容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com