
(1).等物质的量的CO和CO2中所含O原子个数之比 ,C原子数之比 ,二者的质量之比 。
(2)下列物质中:(1)Cu (2) Br2 ⑶Na2O ⑷蔗糖 ⑸NaCl溶液 ⑹ SO3 ⑺Ba(OH)2
属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填写)
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下:
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的 溶液的原因______。
溶液的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)配制方法:设计五个操作步骤。
①向盛有NaOH固体的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm;
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,然后将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将操作步骤正确排序 。
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是 。
| A.使用滤纸称量氢氧化钠固体 |
| B.容量瓶中原来存在少量蒸馏水 |
| C.溶解后的烧杯未经多次洗涤 |
| D.胶头滴管加水定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol?L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol?L-1的稀盐酸。
①容量瓶上需标有以下五项中的 。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序 (字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取浓盐酸 mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃杯注入 中
D.将容量瓶盖紧,颠倒摇匀
E.改用 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面至刻度线下 处。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______为______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中______为______。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中______为______。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中______为______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 。该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。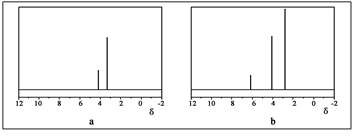
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
(4)已知H2S高温热分解制H2的反应为:H2S(g) H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。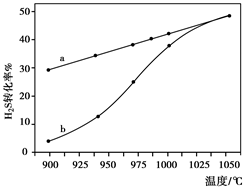
(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)=CO2(g)+2H2(g)现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为 。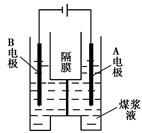
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某小组用铜屑制取硫酸铜溶液。将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气其反应原理为2Cu+O2+2H2SO4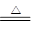 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
(1)参加反应的氧气在标准状况下的体积是 。
(2)所得硫酸铜溶液的物质的量浓度是 。
(3)取100 mL上述硫酸铜溶液,加水稀释至0.1 mol/L,稀释后硫酸铜溶液的体积是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制。
(1)本实验室中需要的容器是 。
(2)要将浓硫酸在 中稀释,稀释时的操作方法是 。
(3)必须将稀释后的硫酸 后再移液,原因是 ,
否则,所配制的稀硫酸浓度会 (偏高、偏低、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制溶液除烧杯和玻璃棒,还需要的仪器是 、 、 。
③实验开始时,需要检查 。
④配制时,下列操作正确的顺序是(用字母表示) 。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
⑤在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )
Ⅲ.配制时,容量瓶有少量蒸馏水( )]
Ⅳ.定容时仰视刻度线( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com