
【题目】通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A. HClB. Cl2C. NH3D. CO
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”因此,研究烟气的脱硝(除NOx)、脱硫(除SO2)技术有着积极的环保意义。
(1)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。

①图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是___________。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_______________________________________________ (任答一条即可)。
(2)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200℃时:Ⅰ.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;
II. N2H4(g)+H2(g) =2NH3(g) ΔH2=-41.8 kJ·mol-1。
①写出肼的电子式:____________________。
②200℃时,肼分解成氮气和氢气的热化学方程式为:_____________________________。
③目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如下图所示。

为达到最佳脱硝效果,应采取的条件是_________________________________________。
(3)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为NH4+和SO42-,阳极的电极反应式为____________________________;物质A是______________ (填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养平衡、科学使用食品添加剂有助于健康和提高免疫力。

(1)维生素C又称抗坏血酸,在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的________性(填“氧化”或“还原”)。
(2)某种食品的配料标签如图所示。该配料中,属于防腐剂的是________,蛋白质在人体内水解的最终产物是氨基酸,氨基酸结构中含有的官能团有氨基和____________(填结构简式)。
(3)“阿司匹林”是一种解热镇痛药,遇潮湿空气或水能缓慢水解生成水杨酸(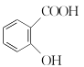 )和醋酸,写出该反应的化学方程式:__________________________。
)和醋酸,写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H= a kJ·mol-1
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ·mol-1、+52.3 kJ·mol-1。则a=___________。
II.乙烧氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:
2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
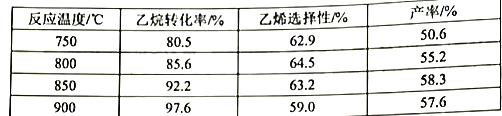
(2)①反应的平衡常数表达式为K=___________,K(750℃)___________K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是___________。根据表中数据选择适宜的反应温度为___________。
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。
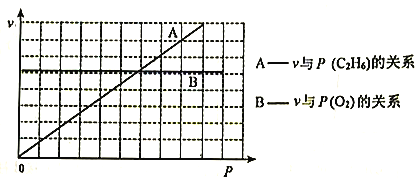
(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________,n=___________。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为______________________,这种电池工作过程中没有CO2排放,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣A组的同学们利用废硫酸溶液制备K2SO4晶体,设计流程如下图所示:
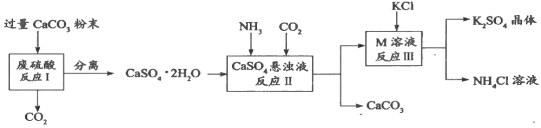
(1)写出反应Ⅰ的化学方程式:______________________。
(2)反应Ⅱ生成了一种可用作肥料的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是_________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____________;为了检验此晶体是否洗涤干净,取最后一次洗涤液于试管中,先加入过量的_______(选填字母),振荡、静置, 再向上层清液中滴加_______(选填字母),观察现象即可判断该晶体是否洗涤干净。
A. AgNO3溶液 B. BaCl2溶液 C. Ba(NO3)2溶液 D .Ba(OH)2溶液 E. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是制硝酸的主要反应之一,其微观示意图如下。下列说法正确的是( )

A.甲的化学式为NH3 , 其水溶液呈碱性B.该反应中元素的化合价都发生改变
C.该反应中甲、乙的质量比为17 :32D.生成物丙、丁的分子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题
(1)某地产石灰石所含杂质不溶于水也不与盐酸反应。为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,此时称量烧杯及其中溶液,总质量为261.2g,求:
①石灰石中碳酸钙的质量为__________克。
②反应后溶液中溶质的质量分数为__________(保留两位有效数字)。
(2)某厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
①计算可得此钢样粉末中铁和碳的质量之比为__________。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2克 H2的体积为22.4L)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
根据表中的数据计算,硫酸溶液中H2SO4溶质的质量分数是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com