
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol ,所以该反应的反应热为:△H=△H1+△H2=+117.6kJ/mol+41.2kJ/mol
,所以该反应的反应热为:△H=△H1+△H2=+117.6kJ/mol+41.2kJ/mol 进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=
进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=| 0.53 |
| 0.52 |

| 2.0-x+3.0-x+3x |
| 5.0 |
| P |
| P0 |
| 5(P-P0) |
| P0 |
| 5(P-P0) |
| P0 |
| 5(P-P0) |
| 2P0 |
| 2.5(P-P0) |
| P0 |
| 5(P-P0) |
| P0 |
| 5(P-P0) |
| 2P0 |
 ,故答案为:
,故答案为: .
.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、0.1mol?L-1 NaAlO2溶液:Al3+、Na+、Cl-、SO42- |
| B、氢氧化铁胶体:K+、S2-、Br-、H+ |
| C、加入Al能放出H2的溶液中:Mg2+,NO3-,K+,SO42- |
| D、由水电离出的c(OH-)=1×10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
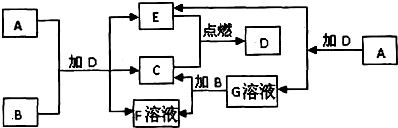
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | ||
B、
| ||
| C、含有0.1 mol?L-1 Ca2+溶液中:Na+、K+、CO32-、Cl- | ||
| D、Na2S溶液中:SO42-、K+、Cl-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成Cu的物质的量是0.1mol |
| B、转移电子的物质的量是0.2mol |
| C、随着电解的进行溶液pH减小 |
| D、阳极反应式是4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com