
【题目】ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:

已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用CO2或SO2代替B.b中NaClO2可用饱和食盐水代替
C.c中广口瓶最好放在冰水浴中冷却D.d中吸收尾气后只生成一种溶质
【答案】C
【解析】
根据实验装置和反应方程式可知,a中用盐酸和NaClO3反应制取ClO2,由于制取的ClO2中混有氯气和挥发出的氯化氢气体,可用b装置吸收氯气和氯化氢,再用c中的蒸馏水吸收ClO2,获得纯净ClO2溶液,d中的氢氧化钠用于吸收尾气,防止污染环境,据此分析解答。
A.a中通入的N2的目的是氮气性质稳定且不影响实验,可将a中产生的ClO2和Cl2吹出并进入后续装置,继续实验,二氧化硫具有还原性,可将ClO2、NaClO3等物质还原,故A错误;
B.b中NaClO2的作用是吸收ClO2中混有的氯气和氯化氢杂质气体,用饱和食盐水可吸收氯化氢,但不能吸收氯气,故B错误;
C.ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体,故c中广口瓶最好放在冰水浴中冷却,有利于吸收ClO2,故C正确;
D.d中氢氧化钠和ClO2发生歧化反应生成NaCl和NaClO3,产物至少两种,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列图示的四种实验操作名称从左到右依次是( )

A.过滤、蒸发、蒸馏、分液B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
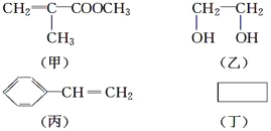
填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
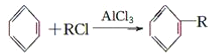 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 1 mol Cl2参加反应转移电子数一定为2NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C. 根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀)>HNO3(浓)
NO2可知,氧化性:HNO3(稀)>HNO3(浓)
D. 含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
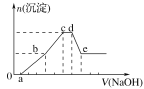
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
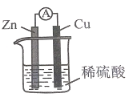
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答下列问题:
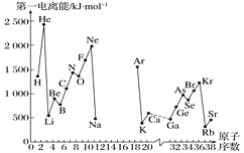
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
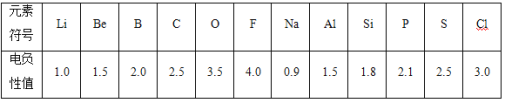
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<________(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________:
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______周期__________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______性,其中Be(OH)2显示这种性质的离子方程式是____________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________,说出理由并写出判断的方法_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com