
����Ŀ������ͼ��ʾװ�òⶨþ����Ʒ�е��ʵ������������������ᷴӦ���������壩�����������գ�
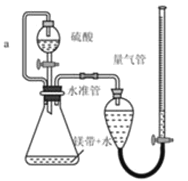
��1�������ӷ���ʽ��ʾ��ʵ��ķ�Ӧԭ����____________��
��2������þ������Ķ��������� _______________��
��3��������������Ŀ����_____________��
��4������a�������� ____________ ��
��5������ⶨ���ƫ�ߣ����ܵ�ԭ����____________����ѡ���ţ�
a װ��©�� b δ��ȴ�����¼�����
c þ���к�������þ dδ����ʱ�����ܵ�Һ�����ˮ��
���𰸡�Mg+2H+![]() Mg2++H2
Mg2++H2![]() ������ƽ ʹþ����ȫ��Ӧ ʹ����˳�����£�����������Һ�����������IJⶨ����Ӱ�� bd
������ƽ ʹþ����ȫ��Ӧ ʹ����˳�����£�����������Һ�����������IJⶨ����Ӱ�� bd
��������
(1)þ��ϡ���ᷴӦ��������þ��������
(2)����þ��������������Ҫ֪����Ʒ��������
(3)ʵ������Ҫͨ�����������ʵ������þ�����������Լ������������أ�ȷ��Mg��ȫ��Ӧ��
(4)����a��ƽ����ѹ��ʹ��Һ©���е�����˳�����£�
(5)ͨ�����������ʵ������þ���������Ӷ������Ʒ��þ���������������ⶨ���������ƫС����ⶨ���ƫ�ͣ����ⶨ���������ƫ�ߣ���ⶨ���ƫ�ߣ��ݴ˽��з�����
(1)þ��ϡ���ᷴӦ��������þ����������Ӧ�����ӷ�Ӧ����ʽΪ��Mg+2H+= Mg2++ H2����
(2)ʵ���вⶨþ����Ʒ�е���þ��������������Ҫ��ȷ����þ������������������Ķ�������������ƽ��
(3)ʵ������Ҫͨ�����������ʵ������þ���������Ӷ������Ʒ��þ���������������Լ����������������ȷ��Mg��ȫ��Ӧ��
(4)�淴Ӧ�Ľ��У���ƿ���������࣬ѹǿ����Һ©���е�����������£�Ϊ��ƽ����ѹ���õ���a����Һ©������ƿ�����������Ϳ���ʹ����˳�����£����Ե���a��������ƽ����ѹ��ʹ����˳�����£�
(5)a��װ��©�����������������С���ⶨ���ƫ�ͣ���a����
b��δ��ȴ�����¼�������������������ԭ����֪���ⶨ���������ƫ�ⶨ���ƫ�ߣ���b��ȷ��
c��þ���к�������þ���������������ƫС���ⶨ���ƫ�ͣ���c����
d��ĩ����ʱ�����ܵ�Һ�����ˮ�ܣ����¶������ƫ�ⶨ���ƫ�ߣ���d��ȷ��
�ʴ�Ϊ��bd��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���3�������Ϊ1.0L�ĺ����ܱ������з�Ӧ2H2(g)+CO(g)![]() CH3OH(g)�ﵽƽ�⡣����˵����ȷ���ǣ� ��
CH3OH(g)�ﵽƽ�⡣����˵����ȷ���ǣ� ��
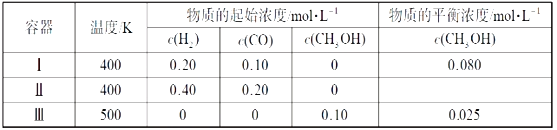
A.�ﵽƽ��ʱ���������з�Ӧ��ת���ʱ��������еĴ�
B.�÷�Ӧ������Ӧ����
C.�ﵽƽ��ʱ����������c(H2)������������c(H2)������
D.�ﵽƽ��ʱ���������е�����Ӧ���ʱ��������е�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������ĵ���ƽ�ⳣ�����£�
��ѧʽ | HF | HCN | H2CO3 |
���볣�� | Ka��3.5��10��4 | Ka��5.0��10��10 | Ka1��4.3��10��7�� Ka2��5.6��10��11 |
��1��c(H+)��ͬ�������ᣬ�����Ũ�ȴӴ�СΪ________________��
��2��0.0lmol/L��HCN��Һ�У�c(H+)ԼΪ_____mol/L��ʹ����Һ��HCN�ĵ���̶�������c(H+)Ҳ����ķ�����_______________________��
��3���к͵�����NaOH�����ĵ�pH�����������������ֱ�ΪaL��bL����a_____b������ڡ�����С�ڡ����ڡ�����ͬ��b���к͵�Ũ�ȡ��������������������ҪNaOH�����ʵ���Ϊn1��n2����n1_____n2��
��4����NaCN��ͨ��������CO2�����������ӷ���ʽΪ_______________��
��5�����ʵ��֤�������������������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȡ����Ӧ����
��CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
��CH3CH2OH![]() CH2CH2+H2O
CH2CH2+H2O
��CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
��C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A.�٢�B.�ۢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ����

A.ͼ�ױ�ʾѹǿ�Կ��淴Ӧ2A(g)+2B(g)![]() 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
B.ͼ���ǽ��ʯ��ʯī�ֱ���������CO2��������ϵ���ߣ�˵��ʯīת��Ϊ���ʯ�ķ�Ӧ����H>0
C.ͼ����ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ�������(N2����ʼ���㶨)�ı仯��ͼ��a��N2��ת���ʴ���b��
D.ͼ����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬ������NaA��Һ��pH����ͬŨ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������㷺������ҩ�Ⱦ�ϡ����ϵȹ�ҵ����ѧ��ѧʵ�鳣��װ�����Ʊ���
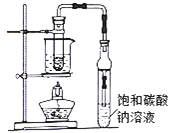
���������գ�
(1)д��ʵ�����Ʊ����������Ļ�ѧ����ʽ��_______ͨ����������Ҵ���ԭ����_______
(2)����̼������Һ�������Ǣ�__________��__________
(3)����װ���Ʊ�������������ȱ����_________��_________���߷�Ӧ��ͨ����Һ©���ߵμ����ᣬ������������������������������������IJ��ʡ���ԭ����______
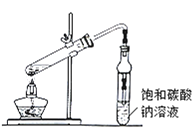
(4)�������ֲ�Ʒ����������������Ҵ��Ļ������п�ͼ�Ƿ��������������ͼ��
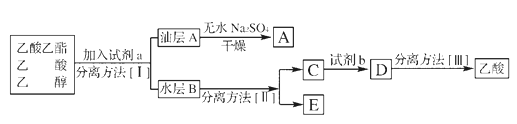
���뷽��II��____________�Լ�b��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��250Cʱ����20.0mL0.10mol/L��ˮ�е���0.10mol/L���ᣬ��Һ��pH����������������ϵ��ͼ��ʾ����֪0.10mol/L��ˮ�ĵ����Ϊ1.32%�������й���������ȷ���ǣ� ��
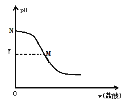
A.��ʵ��Ӧѡ�õ�ָʾ���Ǽ���
B.M�㴦����Һ��c(NH4+)=c(Cl)>c(H+)=c(OH)
C.N�㴦����Һ��pH<12
D.M���Ӧ���������Ϊ20.0mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ�������ֽ����ֱ��ͬ���ͬŨ�ȵ����ᷴӦ��ͬ��ͬѹ�£�������ͬ�������������μӷ�Ӧ�Ľ��� �� ��
A.��ʧȥ�ĵ��������B.�μӷ�Ӧ�Ľ����������
C.�μӷ�Ӧ�Ľ������ʵ�����ͬD.����þ������������Ϊ56��24��27
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
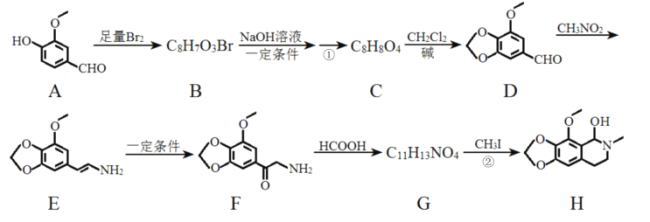
����Ŀ���ǿɶ���һ��ҩ�Ϊ֧���ܽ⾷�����ҩ���ܽ��֧����ƽ�������Σ����Ʒ�ǣ�ŷ�������Ŀ��ԣ�������H���Ʊ���ҩ�����Ҫ�м��壬�ϳ�·����ͼ��
��֪��
a.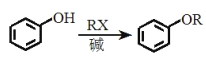 ��
��
b.RNH2![]() RNHCH3��
RNHCH3��
��1����Ӧ�ٵ�����Ϊ__��
��2����Ӧ�ڵķ�Ӧ����Ϊ__��
��3��������G�Ľṹ��ʽΪ__��
��4������˵����ȷ����__��
a������D����FeCl3������ɫ��Ӧ
b������F�����
c������G�ܺ�������Һ������Ӧ
d������H�ķ���ʽ��C12H15NO4
��5��д��C��D�Ļ�ѧ����ʽ��__��
��6����������������������A����ͬ���칹����__�֣�������A����
�ٿ�����������Ӧ����������������NaHCO3��Һ��Ӧ��
�ڷ����к���![]() �ṹ��
�ṹ��
�ۺ��б�������������ȡ������
��7����֪CH2=CHCH3![]() CH2=CHCH2Cl������
CH2=CHCH2Cl������![]() ��CH3CHClCH3Ϊԭ�Ϻϳɻ�����
��CH3CHClCH3Ϊԭ�Ϻϳɻ�����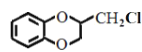 ��д���Ʊ��ĺϳ�·������ͼ�����Լ���ѡ��__��
��д���Ʊ��ĺϳ�·������ͼ�����Լ���ѡ��__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com