
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10﹣4 | Ka=5.0×10﹣10 | Ka1=4.3×10﹣7, Ka2=5.6×10﹣11 |
(1)c(H+)相同的三种酸,其酸的浓度从大到小为________________。
(2)0.0lmol/L的HCN溶液中,c(H+)约为_____mol/L。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是_______________________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a_____b(填“大于”、“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_____n2。
(4)向NaCN中通入少量的CO2,发生的离子方程式为_______________。
(5)设计实验证明氢氟酸比盐酸的酸性弱__________________。
【答案】c(HCN)>c(H2CO3)>c(HF) ![]() ×10﹣6 升高温度 小于 小于 CN﹣+CO2+H2O=HCN+HCO3﹣ 测定等物质的量浓度的NaCl和NaF溶液中pH:NaF溶液的pH>7,则HF酸性弱;或测定等浓度的两种酸的pH,HF的pH大,则氢氟酸比盐酸的酸性弱
×10﹣6 升高温度 小于 小于 CN﹣+CO2+H2O=HCN+HCO3﹣ 测定等物质的量浓度的NaCl和NaF溶液中pH:NaF溶液的pH>7,则HF酸性弱;或测定等浓度的两种酸的pH,HF的pH大,则氢氟酸比盐酸的酸性弱
【解析】
由表中数据可知,HF的酸性最强,HCN的酸性介于H2CO3和HCO3-之间。
(1)酸性越强电离出的氢离子浓度越大,因此c(H+)相同的三种酸,其酸的浓度从大到小为c(HCN)>c(H2CO3)>c(HF)。
(2)0.0lmol/L的HCN溶液中,c(H+)约为![]() mol/L =
mol/L =![]() ×10﹣6 mol/L。弱酸的电离过程是吸热过程,因此,使此溶液中HCN的电离程度增大且c(H+)也增大的方法是:升高温度。
×10﹣6 mol/L。弱酸的电离过程是吸热过程,因此,使此溶液中HCN的电离程度增大且c(H+)也增大的方法是:升高温度。
(3)硫酸是强酸,其已完全电离,而氢氟酸只有很少的一部分发生电离,因此用等pH的氢氟酸和硫酸中和等量的NaOH,氢氰酸用量较少,故a小于b。由于硫酸是二元酸,而氢氰酸是一元酸,因此中和等浓度、等体积的氢氟酸和硫酸,需要NaOH的物质的量为2n1=n2,则n1小于n2。
(4)HCN的酸性介于H2CO3和HCO3-之间,因此向NaCN中通入少量的CO2发生反应的离子方程式为CN﹣+CO2+H2O=HCN+HCO3﹣。
(5)弱酸强碱盐可以水解使其溶液呈碱性,而强酸强碱盐不水解;在水溶液中,弱酸只有部分电离,而强酸可以完全电离,因此,设计实验证明氢氟酸比盐酸的酸性弱的方法可以是:测定等物质的量浓度的NaCl和NaF溶液中pH:NaF溶液的pH>7,而NaCl溶液的pH=7,则HF酸性弱;或测定等浓度的两种酸的pH,HF的pH大,则氢氟酸比盐酸的酸性弱。


科目:高中化学 来源: 题型:
【题目】化学在科技进步方面发挥着重要的作用。下列说法正确的是
A. 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为![]() ,N为
,N为![]()
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )

A. 根据图①溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量Cu,至pH在4左右。
B. 图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 图③表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D. 根据图④可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的化学平衡常数K随温度升高而变小
2AB3(g)的化学平衡常数K随温度升高而变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是 ___。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式____。LiAlH4在化学反应中通常作_______(填“氧化”或“还原”)剂。工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为 _________
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
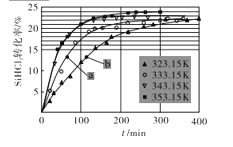
①353.15K时,平衡转化率为____,该反应是____反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是____。
(4)比较a、b处反应速率的大小:Va ___Vb (填“>”“<”或“=”)。已知反应速率V正=K1x2SiHCl3,V逆=K2xSiH2Cl2xSiCl4,K1,K2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时K1/K2 =____(保留3位小数)。
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是 ___,其原因是____。已知:H2SiO3 :Ka1=2.0×10-10、Ka2=2.0×10-12、H2CO3 :Ka1=4.3×10-7,Ka2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛常温下为无色液体,熔点-23.2℃,沸点136.4℃,极易水解。在900℃时,将氯气通过钛铁矿(主要成分是FeTiO3)和炭粉的混合物可反应生成四氯化钛和氯化铁(熔点306℃,沸点315℃),同时产生一种有毒气体。现制取并收集四氯化钛的装置如图所示(夹持装置略去)。
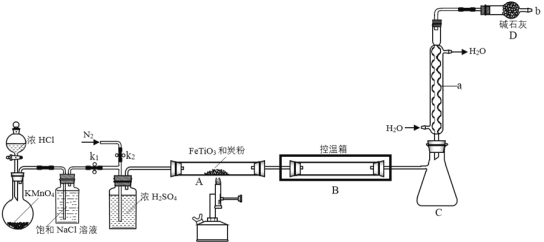
回答下列问题:
(1)仪器a的名称是____。组装好仪器,没加试剂反应前,应该进行的操作是_____。
(2)反应开始前,先将钛铁矿粉碎,并与稍过量的炭粉混合均匀,制成多孔状固体混合物,目的是______________。
(3)实验中需通入N2两次,第二次通N2的作用是_________。
(4)900℃时,A装置中发生反应的化学方程式为__________。
(5)B装置中控温箱温度在150~200℃,目的是___________。
(6)装置b处存在的缺点是________________。
(7)产物TiCl4在热潮湿空气中“发烟”生成TiO2xH2O,反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
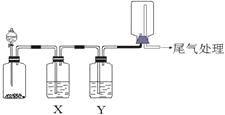
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质的质量分数(杂质与酸反应不产生气体)。完成下列填空:
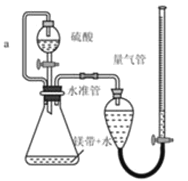
(1)用离子方程式表示该实验的反应原理:____________。
(2)称量镁带所需的定量仪器是 _______________。
(3)硫酸必须过量的目的是_____________。
(4)导管a的作用是 ____________ 。
(5)如果测定结果偏高,可能的原因是____________。(选填编号)
a 装置漏气 b 未冷却至室温即读数
c 镁带中含有氧化镁 d未读数时量气管的液面低于水准管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O
(1)标出上述反应电子转移的方向和总数______。
(2)上述反应中______元素被还原,氧化产物为______,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com