
【题目】已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O
(1)标出上述反应电子转移的方向和总数______。
(2)上述反应中______元素被还原,氧化产物为______,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为______。
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10﹣4 | Ka=5.0×10﹣10 | Ka1=4.3×10﹣7, Ka2=5.6×10﹣11 |
(1)c(H+)相同的三种酸,其酸的浓度从大到小为________________。
(2)0.0lmol/L的HCN溶液中,c(H+)约为_____mol/L。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是_______________________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a_____b(填“大于”、“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_____n2。
(4)向NaCN中通入少量的CO2,发生的离子方程式为_______________。
(5)设计实验证明氢氟酸比盐酸的酸性弱__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250C时,向20.0mL0.10mol/L氨水中滴入0.10mol/L盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
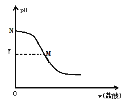
A.本实验应选用的指示剂是甲基橙
B.M点处的溶液中c(NH4+)=c(Cl)>c(H+)=c(OH)
C.N点处的溶液中pH<12
D.M点对应的盐酸体积为20.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镁、铝三种金属分别和同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则参加反应的金属 ( )
A.所失去的电子数相等B.参加反应的金属质量相等
C.参加反应的金属物质的量相同D.铁、镁、铝的质量比为56:24:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
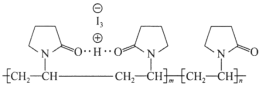 (图中虚线表示氢键)
(图中虚线表示氢键)
A.C、N、O原子的电负性依次增大
B.聚维酮碘中含有离子键、共价键、氢键等化学键
C.聚维酮易溶于水的原因是与水分子间形成氢键
D.分子中的含N五元环一定是平面结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反射引起的咳嗽,化合物H是制备该药物的重要中间体,合成路线如图:
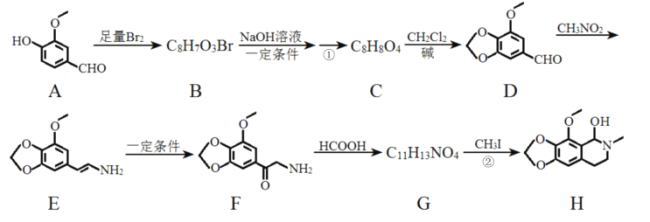
已知:
a.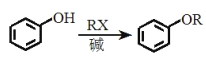 ;
;
b.RNH2![]() RNHCH3。
RNHCH3。
(1)反应①的条件为__。
(2)反应②的反应类型为__。
(3)化合物G的结构简式为__。
(4)下列说法正确的是__。
a.物质D能与FeCl3发生显色反应
b.物质F具有碱性
c.物质G能和银氨溶液发生反应
d.物质H的分子式是C12H15NO4
(5)写出C→D的化学方程式:__。
(6)满足下列条件,化合物A所有同分异构体有__种(不包括A)。
①可以与活波金属反应生成氢气,但不与NaHCO3溶液反应;
②分子中含有![]() 结构;
结构;
③含有苯环,且有两个取代基。
(7)已知CH2=CHCH3![]() CH2=CHCH2Cl,请以
CH2=CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物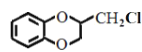 ,写出制备的合成路线流程图(无机试剂任选)__。
,写出制备的合成路线流程图(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com