
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是__(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000g样品,放入盛有20mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50mL;
c.立即用0.2000mol·L-1Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积:
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00mL.
已知:CuC1+Fe3+=Cu2++Fe2++Cl-、Fe2++Ce4+=Fe3++Ce3+
①配制100mL0.2000mol·L-1的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要___。
②进行步骤c时若操作缓慢,则测得CuCl的纯度___(“偏大”、“偏小”或“无影响")。
③通过计算确定该样品中CuCl的纯度___(写出计算过程)。
【答案】Na2SO3 100ml容量瓶 偏小 99.5%
【解析】
(1)盐酸、亚硫酸根离子和铜离子发生氧化还原反应生成CuCl白色沉淀、硫酸根离子,氧化还原反应中,失电子化合价升高的反应物是被氧化的物质,也是还原剂,得电子化合价降低的反应物是被还原的物质,也是氧化剂;
(2)①根据配制一定物质的量浓度的溶液使用的仪器解答;
②步骤c发生反应:Fe2++Ce4+=Fe3++Ce3+,若操作缓慢,亚铁离子被氧气氧化;
③依据方程式CuCl+Fe3+=Cu2++Fe2++Cl-、Fe2++Ce4+=Fe3++Ce3+中各反应物量之间的关系,可得关系式:CuCl~Ce4+,据此计算CuCl的纯度。
(1)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀发生氧化还原反应,反应的离子方程式为:![]() ,该反应中化合价变化Cu(+2→+1),S(+4→+6),氧化还原反应中,失电子化合价升高的反应物是被氧化的物质,该反应中被氧化的物质是Na2SO3,故答案为:Na2SO3;
,该反应中化合价变化Cu(+2→+1),S(+4→+6),氧化还原反应中,失电子化合价升高的反应物是被氧化的物质,该反应中被氧化的物质是Na2SO3,故答案为:Na2SO3;
(2)①配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,配制100mL溶液用到的仪器有托盘天平(称量)、药匙、玻璃棒(溶解、移液)、胶头滴管(定容)、烧杯(溶解)、100mL容量瓶(定容、摇匀)故还需要的玻璃仪器有:100mL容量瓶,故答案为:100mL容量瓶;
②亚铁离子易被氧气氧化,步骤c发生反应:Fe2++Ce4+=Fe3++Ce3+,根据CuCl~Ce4+,计算CuCl的纯度,进行步骤c时若操作缓慢,被氧化的亚铁离子不再与Ce4+反应,则测得CuCl的纯度偏小,故答案为:偏小;
③称取0.5000g样品,放入盛有20mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;发生反应:CuCl+FeCl3═CuCl2+FeCl2,用0.2000molL-1Ce(SO4)2标准溶液滴至反应完全,发生反应Fe2++Ce4+=Fe3++Ce3+,可得关系式:CuCl~Ce4+,故n(CuCl)=n(Ce4+)=0.2000molL-1×25.00×10-3L=5.000×10-3mol,则CuCl的纯度为![]() ,故答案为:99.5%。
,故答案为:99.5%。


科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
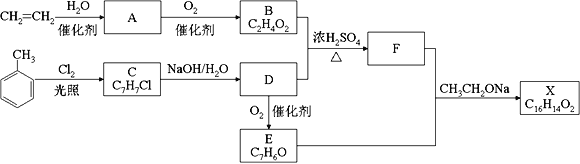
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH![]() 、CO
、CO![]() 、NO
、NO![]() 、OH-、SO
、OH-、SO![]() ,将这4种溶液分别标记为A、B、C、D并进行如下实验:
,将这4种溶液分别标记为A、B、C、D并进行如下实验:
①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)A的化学式是________。
(2)写出其他几种物质的化学式:B________、C________、D________。
(3)写出实验③中有关反应的离子方程式________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
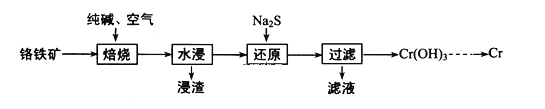
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___。
②浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为___。
(2)已知25℃时Cr3+恰好完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
①电极b连接电源的__极(填“正”或“负”),b极发生的电极反应:___。
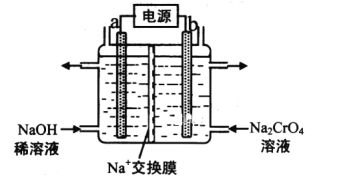
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
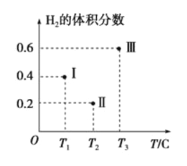
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.23gNa与氧气充分反应,生成Na2O和Na2O2的混合物,转移的电子数为大于NA小于2NA
B.0.5mol甲醇中含有的共价键数为2.5NA
C.标准状况下,0.25molHF的体积为5.6L
D.0.2mol/L的Na2SO4溶液中含Na+ 数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应的离子方程式,或根据离子方程式,写一个符合条件的化学方程式。
①碳酸镁和足量稀盐酸反应______________________。
②碳酸氢钠与硫酸反应__________________________。
③MnO2+4HCl![]() MnCl2+Cl2↑ +2H2O_____________________。
MnCl2+Cl2↑ +2H2O_____________________。
④Zn+2Ag+=Zn2++2Ag _______________________。
⑤CO32- + 2H+=H2O + CO2↑_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com