
已知反应mX(g)+nY(g)  qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n :m
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1 mol H2O的质量为18 g/mol
B.CH4的摩尔质量为16 g
C.3.01×1023个SO2分子的质量为32 g
D.2 mol NaOH溶于1 L水中配成溶液的浓度为2 mol·L―1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化。
A.①②③④ B.③④ C.③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
用化学术语回答下列问题:
(1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ·mol-1,写出其热化学方程式: .
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+1/2 O2(g)==H2O(l)
的△H= kJ·mol-1,氢气的燃烧热为 kJ·mol-1。
(2)电解硝酸银溶液电极反应式(惰性电极)
①阳极:
②阴极:
(3)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2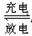 Ag2O+Zn+H2O在此电池放电时,正极的电极反应式为 。
Ag2O+Zn+H2O在此电池放电时,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
A.2H2(g)+O2(g) ==2H2O(l) △H1; 2H2(g)+O2(g) ==2H2O(g) △H2
B.N2(g)+3H2(g)  2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2
2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2
C.C(s)+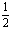 O2(g) == CO(g) △H1; C(s)+O2(g) == CO2(g) △H2
O2(g) == CO(g) △H1; C(s)+O2(g) == CO2(g) △H2
D.H2(g)+Cl2(g) ==2HCl(g) △H1; 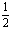 H2(g)+
H2(g)+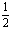 Cl2(g) == HCl(g) △H2
Cl2(g) == HCl(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:2H2 (g) + O2 ( g ) = 2H2O(l); △H = -571.6 kJ/mol
2H2 (g) + O2 (g) = 2H2O (g); △H = -483.6 kJ/mol
CH4 (g) + 2O2 (g) = 2H2O(l)+ CO2(g); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ, 试求混合气体中甲烷和氢气体积比为 。
(2)将N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
①反应前混合气体中N2和 H2的体积比为 。
②达到平衡时混合气体中的氨的体积分数为 。(保留三位有效数字)
③平衡时N2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )。
A.只有AgBr沉淀生成 B.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
C. AgCl和AgBr沉淀等量生成 D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com