
【题目】下列说法中正确的是
A.常温下,稀释![]() 的氨水,溶液中
的氨水,溶液中![]() 、
、![]() 、
、![]() 均下降
均下降
B.![]() 的
的![]() 溶液:
溶液:![]()
C.常温下,![]() 相等的
相等的![]() 溶液中,溶质物质的量浓度大小关系是
溶液中,溶质物质的量浓度大小关系是![]()
D.当溶液中存在的离子只有![]() 、
、![]() 、
、![]() 、
、![]() 时,该溶液中离子浓度大小关系可能为
时,该溶液中离子浓度大小关系可能为![]()
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
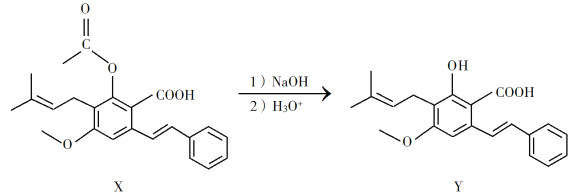
下列有关化合物X、Y的说法正确的是
A. 1 mol X最多能与2 mol NaOH反应
B. Y与乙醇发生酯化反应可得到X
C. X、Y均能与酸性KMnO4溶液反应
D. 室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充、放电的化学方程式为:2K2S2+KI3![]() K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
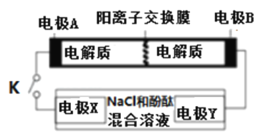
A.K+从右到左通过阳离子交换膜
B.A的电极反应式为:3I﹣﹣2e﹣=I3﹣
C.当有0.1molK+通过离子交换膜,X电极上产生标准状况的气体1.12L
D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3-)的比值将减小
B.pH=1的一元酸和pH=13的一元碱等体积混合后溶液不一定呈中性
C.0.1mol/L硫酸铵溶液中:![]()
D.0.1mol/L的硫化钠溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据方程式所表示的氧化还原反应设计一个原电池:Fe + H2SO4 = H2↑+ FeSO4
(1)装置采用烧杯和盐桥,画出此原电池的装置图______________
(2)指出原电池的正极材料和负极材料并标出电子的流向:正极材料_________,负极材料________ ,电子的流向_________
(3)写出两个电极上的电极反应并指出现象:负极反应 ___________ 、现象___________正极反应___________、现象_________________
(4)转移的电子数为2NA时,生成的H2在标准状况下的体积为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
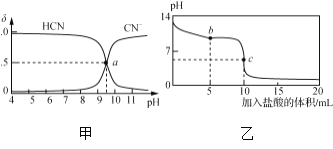
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲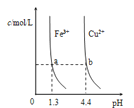 图乙
图乙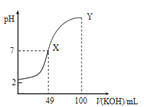
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com