
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲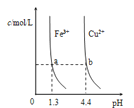 图乙
图乙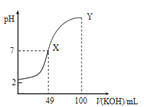
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释![]() 的氨水,溶液中
的氨水,溶液中![]() 、
、![]() 、
、![]() 均下降
均下降
B.![]() 的
的![]() 溶液:
溶液:![]()
C.常温下,![]() 相等的
相等的![]() 溶液中,溶质物质的量浓度大小关系是
溶液中,溶质物质的量浓度大小关系是![]()
D.当溶液中存在的离子只有![]() 、
、![]() 、
、![]() 、
、![]() 时,该溶液中离子浓度大小关系可能为
时,该溶液中离子浓度大小关系可能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+的浓度变化曲线如图所示,下列说法正确的是( )
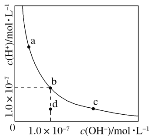
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂 1 mol 共价键所需要吸收的能量分别为 H-H 键:436 kJ;I-I 键:153 kJ;H-I 键:299 kJ。下列对反应 H2(g)+I2(g)2HI(g)的判断中,错误的是( )
A.该反应是放出能量的反应B.该反应是吸收能量的反应
C.该反应是氧化还原反应D.I2 与 H2 具有的总能量大于生成的 HI 具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,溶液中-lgc(Cu2+)与滴加的Na2S溶液体积(V)的关系如图所示(忽略体积变化)。下列判断正确的是
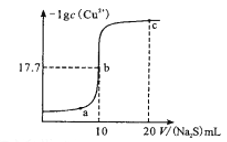
A. a、b、c三点中,b点水的电离程度最大
B. a点:2c(Cu2+)+c(H+)=c(Cl-)+c(OH-)
C. c点溶液:c(Cu2+)=3×10-34.4mol/L
D. c点溶液有:n(S2-)+n(HS-)+n(H2S)=n(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸![]() 是一种精细磷化工产品,具有较强还原性,
是一种精细磷化工产品,具有较强还原性,![]() 可用电渗析法制备。“四室电渗析法”工作原理如图所示
可用电渗析法制备。“四室电渗析法”工作原理如图所示![]() 阳膜和阴膜分别只允许阳离子、阴离子通过
阳膜和阴膜分别只允许阳离子、阴离子通过![]() ,回答下列问题:
,回答下列问题:

![]() 写出阳极的电极反应式:________。
写出阳极的电极反应式:________。
![]() 请判断离子交换膜类型:A________,B________。
请判断离子交换膜类型:A________,B________。![]() 填“阴膜”或“阳膜”
填“阴膜”或“阳膜”![]()
![]() 早期采用“三室电渗析法”制备
早期采用“三室电渗析法”制备![]() :将“四室电渗析法”中阳极室的稀硫酸用
:将“四室电渗析法”中阳极室的稀硫酸用![]() 稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向恒容密闭容器中加入2mol X和4 mol Y,发生如下反应:X(s)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化B.V正(X)=2V逆(Z)
C.容器内X、Y、Z的浓度相等D.容器内气体密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法错误的是( )
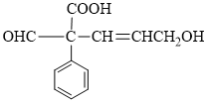
A.该有机物的分子式为C12H12O4
B.1 mol该有机物最多能与4 mol H2反应
C.该有机物可与NaHCO3溶液反应放出CO2,生成2.24 L CO2(标准状况下)需要0.1 mol该有机物
D.该有机物可发生氧化、取代、加成和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol·L-1w溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是
。上述物质的转化关系如图所示。下列说法正确的是
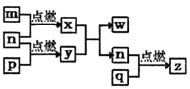
A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com