
 ,逆推可得C的结构简式为
,逆推可得C的结构简式为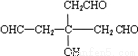 、B为
、B为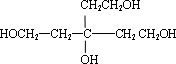 ,故G为
,故G为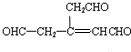 ,E为
,E为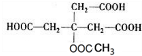 ,F为
,F为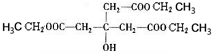 .A只含一种官能团,含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A只含一种官能团,含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为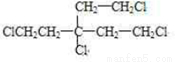 ,据此解答.
,据此解答. ,逆推可得C的结构简式为
,逆推可得C的结构简式为 、B为
、B为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 .A只含一种官能团,含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A只含一种官能团,含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,
, ,含有的官能团为氯原子,故答案为:氯原子;
,含有的官能团为氯原子,故答案为:氯原子;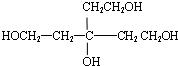 ,C为
,C为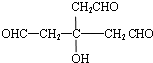 ,B中所有官能团中其中1个羟基没有发生反应,故b错误;
,B中所有官能团中其中1个羟基没有发生反应,故b错误; )发生消去反应生成G,生成G只有1种产物,故c正确;
)发生消去反应生成G,生成G只有1种产物,故c正确;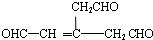 ,其中1个不饱和碳原子上连接2个-CH2CHO,不存在顺反异构现象,故d错误,
,其中1个不饱和碳原子上连接2个-CH2CHO,不存在顺反异构现象,故d错误,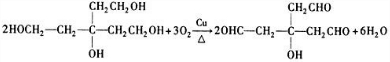 ,
,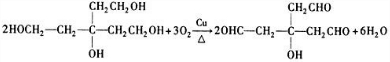 ;
; )互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,则H分子含有2故酚羟基,且H苯环上的一氯代物只有两种,符合条件的H的结构简式为:
)互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,则H分子含有2故酚羟基,且H苯环上的一氯代物只有两种,符合条件的H的结构简式为: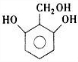 、
、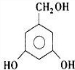 ,故答案为:
,故答案为: 或
或 ;
; ,
, .
.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、1 mol Al3+含有的核外电子数为3NA |
| C、常温常压下,1 mol氦气含有的原子数为NA |
| D、1 L 1 mol?L-1NaOH溶液中氧原子的数目大于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
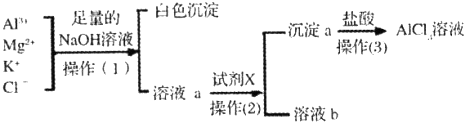
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | |
| Y | Z |
| A、Z元素氧化物对应水化物的酸性一定强于Y |
| B、X、Y、Z中最简单氢化物稳定性最弱的是Y |
| C、X元素形成的单核阴离子还原性强于Y |
| D、Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
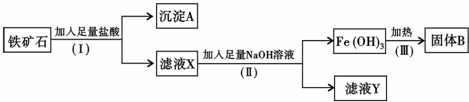
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com