



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
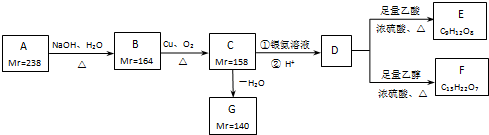
查看答案和解析>>
科目:高中化学 来源: 题型:
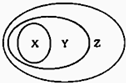 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )| X | Y | Z | |
| A | 置换反应 | 氧化还原反应 | 离子反应 |
| B | 铜 | 单质 | 非电解质 |
| C | 石灰水 | 电解质 | 分散系 |
| D | 液氨 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| c | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
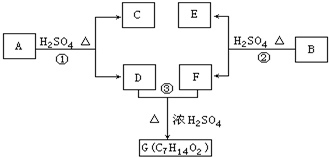 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
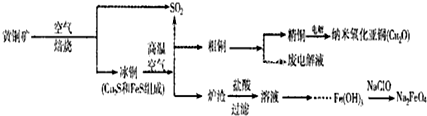
| ||
| ||
n(SO
| 91:9 | 1:1 | 1:91 | ||||
| PH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含H2CO3的溶液:H2CO3═2H++CO32- |
| B、极少量Fe(OH)3溶于水:Fe(OH)3?Fe3++3OH- |
| C、醋酸溶液:CH3COOH??H++CH3COO- |
| D、NaHSO4溶于水:NaHSO4═Na++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com