
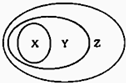
 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )| X | Y | Z | |
| A | 置换反应 | 氧化还原反应 | 离子反应 |
| B | 铜 | 单质 | 非电解质 |
| C | 石灰水 | 电解质 | 分散系 |
| D | 液氨 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | |
| Y | Z |
| A、Z元素氧化物对应水化物的酸性一定强于Y |
| B、X、Y、Z中最简单氢化物稳定性最弱的是Y |
| C、X元素形成的单核阴离子还原性强于Y |
| D、Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 检查装置气密性 |
B、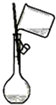 向容量瓶中转移液体 |
C、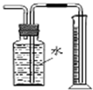 测量Cu与浓硝酸产生气体体积 |
D、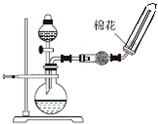 实验室制取并收集NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com