
| 0.11-x+0.11-x+x+3x |
| 0.11+0.11 |
| 3��0.1 |
| 0.01+0.01+0.1+0.3 |
| Y |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��12�� | B�����ж� |
| C������12�� | D����12�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�22.4 L CO2��22.4 L H2SO4������ͬ�ķ����� |
| B����״���£�1mol�����͵����Ļ�����壨����ȣ������ԼΪ22.4 L |
| C��������32g O2����������NA�� |
| D��22.4 L���������ķ�����һ������11.2 L���������ķ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
131 53 |
127 53 |
A��
| ||||
B��
| ||||
C��
| ||||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��KF | B��KBr |
| C��KCl | D��KI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��n��NO2-��+n��OH-��-n��H+��=0.1 mol |
| B����ͨ��0.01 mol HCl���壬��ҺpH����2��������Һ����ı仯�� |
| C������������CH3COONa���壬��Һ�ļ��Ի���� |
| D����ʱ��Һ��pH����0.1 mol/L��CH3COONa��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
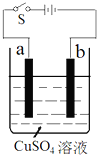 ��ͼ�ǵ�⾫��ͭ��װ��ʾ��ͼ���ش��������⣺
��ͼ�ǵ�⾫��ͭ��װ��ʾ��ͼ���ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com