
 ,故答案为:
,故答案为: ;
; ,CCl4中C原子有4个σ键电子对数,所以C的杂化方式为sp3杂化,
,CCl4中C原子有4个σ键电子对数,所以C的杂化方式为sp3杂化, ;sp3杂化.
;sp3杂化.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
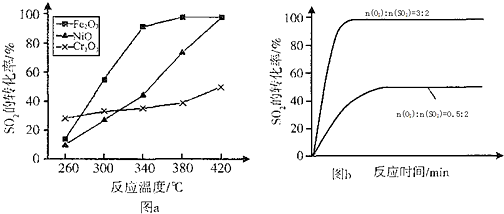
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| B、25℃与60℃时,0.005mol/L的硫酸溶液pH相等 |
| C、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等 |
| D、常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH≈7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④ |
| C、③④⑤ | D、③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com