


科目:高中化学 来源: 题型:
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
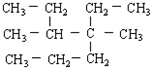 的正确系统命名为
的正确系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和NOx反应的化学方程式为:2xCO+2NOx=2xCO2+N2 |
| B、上述方法的缺点是由于CO2增多,会大大提高空气的酸度 |
| C、多植树造林,增大绿化面积,可有效控制城市空气各种污染源 |
| D、汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、纯醋酸、四氯化碳均为电解质 |
| D、空气、混凝土、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液与过量的氨水反应:Al3++3OH-=Al(OH)3↓ |
| B、工业上用NO2与水反应制取HNO3:3NO2+H2O═NO3-+NO+2H+ |
| C、碳酸氢钠溶液与稀硫酸反应:HCO3-+H+=CO2↑+H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com