
【题目】请阅读下列材料,完成下面小题。
利用Kolbe's电解法制取乙炔的反应原理为: +2H2O
+2H2O 2CO2↑+C2H2↑+H2↑+2KOH
2CO2↑+C2H2↑+H2↑+2KOH
【1】下列表示反应中相关微粒的化学用语错误的是( )
A.中子数为20的钾原子:![]() K
K
B.K+的结构示意图:
C.CO2的电子式:![]()
D.C2H2的结构式:H—C![]() C—H
C—H
【2】有关该反应的下列说法正确的是( )
A.化学能转变为电能
B.电解槽中向阴极迁移的主要是H+
C.电解过程中溶液pH不断减小
D.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
【3】下列羧酸钾盐中,其水溶液电解生成的烃主要是CH2=CH2的是( )
A.CH3COOKB.CH3CH2COOKC.CH2=CHCOOKD.KOOCCH2CH2COOK
【答案】
【1】C
【2】D
【3】D
【解析】
【1】
A.该K的核素中子数为20,质子数为19,故可表示为![]() K,A正确;
K,A正确;
B.K外层共19个电子,K+失去最外层电子,结构示意图为 ,B正确;
,B正确;
C.CO2中C与O之间共用两对电子,电子式为![]() ,C错误;
,C错误;
D.C2H2中C与H之间为单键,C与C之间为三键,结构式为H—C![]() C—H,D正确;
C—H,D正确;
故选C。
【2】
A.该反应是电解反应,是电能转化为化学能,A错误;
B.根据电解反应,电解生成KOH,因此溶液中不会大量存在H+,B错误;
C.电解生成KOH,因此溶液的pH不断增大,C错误;
D.阴极区H2O放电,因此电极反应为2H2O+2e-=2OH-+H2↑,D正确;
故选D。
【3】
根据题目中制乙炔的反应,要生成一个不饱和键需要脱去两个羧酸钾,要制得CH2=CH2,需要有两个羧酸钾,且C和C之间以单键相连,故选D。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
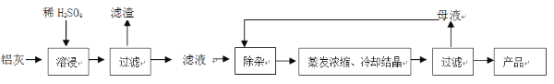
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑥Fe(OH)3不可用Fe2O3与水反应得到,但能通过其它化合反应制取
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、C、N、O元素是与生命活动密不可分的元素,请回答下列问题:
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。已知N2O分子中氧原子只与一个氮原子相连,则N2O的分子空间构型是________。
(2)另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2=2HCl+2COCl2,光气(COCl2)分子的空间构型是________。
(3)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是________(填字母序号)。
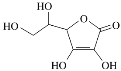
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(4)已知尿素的结构简式为H2NCONH2,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
①基态Fe3+的核外电子排布式为____________。
C、N、O三种元素的第一电离能由大到小的顺序是________。
②尿素分子中C原子和N原子的杂化方式分别是__________。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(+3价)之间的作用力称为__________,与![]() 互为等电子体的一种化合物分子是____________(写化学式)。
互为等电子体的一种化合物分子是____________(写化学式)。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式为
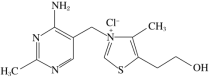
①以下关于维生素B1的说法正确的是________(填字母序号,下同)。
A.只含σ键和π键 B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl D.该物质易溶于盐酸
②维生素B1晶体溶于水的过程中要克服的微粒间作用力有________。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)俗称吊白块,在印染、医药以及原子能工业中应用广泛。某化学兴趣小组以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛。已知次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上会发生分解。实验装置(如图1所示)及步骤如下:

I.在三颈烧瓶中加入一定量的Na2SO3和水,搅拌溶解后缓慢通入SO2,制得NaHSO3溶液。
II.将装置A中导气管换成橡皮塞。向三颈烧瓶中加入稍过量的锌粉和一定量37%的甲醛溶液,不断搅拌,在80~90℃左右的水浴中反应约3h后趁热过滤,试剂X洗涤。
III.将滤液蒸发浓缩,冷却结晶,过滤;往滤液中加入适量试剂Y,析出晶体,过滤;合并滤渣,试剂Z洗涤,干燥得到产品。
请回答下列问题:
(1)Na2SO3水溶液中,含硫微粒H2SO3、HSO3-、SO32-随pH的分布如图2所示,则步骤I中确定何时停止通SO2的实验操作为___。
(2)下列说法中正确的是___。
A.B中烧杯中盛放的试剂可以是NaOH溶液
B.试剂Y是无水乙醇;试剂X与试剂Z都是乙醇的水溶液
C.冷凝管内冷凝回流的主要物质是HCHO
D.步骤III中所选择的干燥操作应为真空干燥
(3)步骤II中的水浴加热相比于与酒精灯直接加热,除了有使三颈烧瓶受热更均匀、较低温度下减少产物的分解之外,还有___的优点。化学兴趣小组的同学为完成所设计的实验,除图1中装置仪器外,还需要使用到的仪器有___。
(4)步骤III中蒸发浓缩时应注意的问题有___(并简要说明理由)。
(5)AHMT分光光度法常用于测定溶液样本中甲醛的浓度。其原理是:甲醛与AHMT溶液在碱性条件下缩合后,经高碘酸钾氧化成一种紫红色化合物,其对特定波长光的吸收程度(即色泽深浅)与甲醛在一定浓度范围内成正比。现测得该紫红色化合物的吸光度A与HCHO标准溶液的浓度关系如图3所示:

该化学兴趣小组的同学设计了如下实验确定次硫酸氢钠甲醛的组成:
I.准确称取1.5400g样品,完全溶于水配制成100mL溶液
II.取25.00mL所配溶液经AHMT分光光度法测得溶液吸光度A=0.4000
III.另取25.00mL所配溶液,加入过量碘完全反应后,再加入BaCl2溶液充分反应,得到0.5825g白色沉淀。其反应原理为:
aNaHSO2bHCHOcH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)。
①通过计算可知次硫酸氢钠甲醛的化学式为___。
②结合三颈烧瓶内发生的合成反应产物分析,题干的步骤II中,不断搅拌的目的为:___。
③若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物。写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
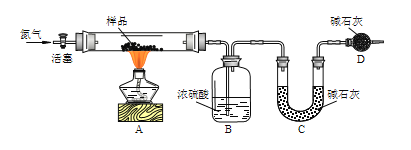
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
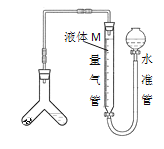
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
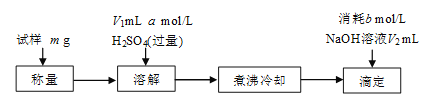
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
| 滴管 | 试管 | |
0.2molL-1 CuSO4溶液 | 0.2molL-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
0.2molL-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
0.2molL-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3yCu(OH)2zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g Na和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
A.整个反应过程中共转移电子0.4 mol
B.反应产生的气体在标准状况下的体积是1.12L
C.反应所得溶液与足量CO2反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.在稀释、定容操作中用到的全部玻璃仪有:烧杯、玻璃棒、500mL容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com