
化学与生活密切相关,下列说法不正确的是
| A.在汽车排气管上加装“催化转化器”可以减少有害气体的排放 |
| B.“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 |
| C.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物",PM2.5在空气中有可能形成胶体 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.工业上利用合成氨实现人工固氮 |
| B.SiO2有导电性,可用于制备光导纤维 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的正极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:(已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀)该同学得出的结论正确的是
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示。其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G的焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一。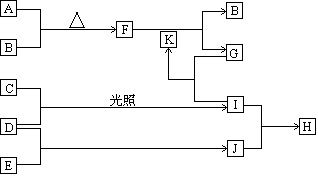
(1)写出五种单质的名称
(2)I、J相遇反应生成H,反应的现象是 ,化学反应方程式为 ,H物质的电子式为
(3)F的颜色为 ,F和K反应的化学方程式为 。
(4)G和H也可以发生反应,若G和H恰好完全反应,则A、B、C、D、E的物质的量之比为 。
(5)D和E的反应是典型的可逆反应,并且是放热反应。该反应的化学方程式为
请用某两种物质的反应速率间的等量关系表明该反应已经达到化学平衡,该等量关系可以是 ;反应物的总能量E反与生成物的总能量E生的大小关系是:E反 E生。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: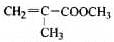
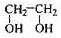
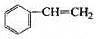

(甲) (乙) (丙) (丁)
填写下列空白:
(1)下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):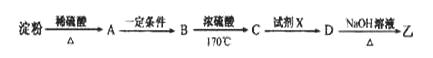
A的分子式是___________,试剂X可以是___________。
(4)已知: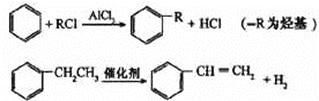
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(27分)氨的合成原理为:N2(g)+3H2(g)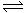 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: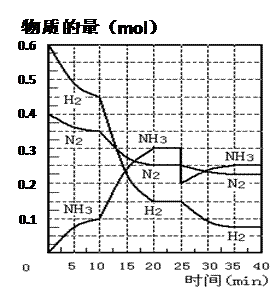
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) + 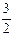 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com