
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示。其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G的焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一。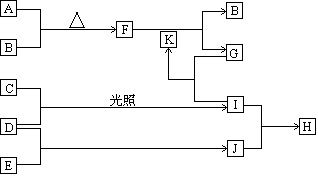
(1)写出五种单质的名称
(2)I、J相遇反应生成H,反应的现象是 ,化学反应方程式为 ,H物质的电子式为
(3)F的颜色为 ,F和K反应的化学方程式为 。
(4)G和H也可以发生反应,若G和H恰好完全反应,则A、B、C、D、E的物质的量之比为 。
(5)D和E的反应是典型的可逆反应,并且是放热反应。该反应的化学方程式为
请用某两种物质的反应速率间的等量关系表明该反应已经达到化学平衡,该等量关系可以是 ;反应物的总能量E反与生成物的总能量E生的大小关系是:E反 E生。
(20分)每空2分(1)钠 氧气 氯气 氢气 氮气(不论顺序,全对得分)
(2)产生白烟 NH3+HCl=NH4Cl 
(3)淡黄色 2Na2O2+ 2H2O=4NaOH + O2↑ (4)2:1:1:4:1
(5)N2+ 3H2 2NH3 v(H2)正=3v(N2)逆(其它答案正确同样得分) >(大于)
2NH3 v(H2)正=3v(N2)逆(其它答案正确同样得分) >(大于)
解析试题分析:G的焰色反应为黄色,这说明G中含有钠元素。A、B、C、D、E为单质,常温下A为固体,因此根据AB反应生成F,F和K反应生成G和B可知,A是钠,B是氧气,F是过氧化钠。C、D是气体单质,依据反应条件是光照,推断为氢气和氯气生成氯化氢的反应,即I是氯化氢。D和E的反应在工农业生产中有重要的意义,由此判断该反应应该是合成氨的反应,所以判断D为H2,E为N2,C为Cl2,J是氨气,H是氯化铵。K为G和I反应的产物之一,所以G是氢氧化钠,K是水。
(1)五种单质的名称钠、氧气、氯气、氢气、氮气。
(2)氯化氢和氨气反应产生产生白烟,反应的化学方程式是NH3+HCl=NH4Cl,生成的氯化铵是含有离子键和共价键的离子化合物,电子式是 。
。
(3)过氧化钠是淡黄色固体,与水反应的化学方程式是2Na2O2+ 2H2O=4NaOH + O2↑。
(4)氢氧化钠和氯化铵恰好反应生成的是一水合氨和氯化钠,则根据原子守恒可知,钠、氧气、氯气、氢气和氮气的物质的量之比=2:1:1:4:1。
(5)合成氨反应的方程式是N2+ 3H2 2NH3。平衡时正逆反应速率相等,则系表明该反应已经达到化学平衡的该等量关系可以是v(H2)正=3v(N2)逆(其它答案正确同样得分) ;因为该反应是放热反应,说明反应物的总能量高于生成物的总能量,即:E反>E生。
2NH3。平衡时正逆反应速率相等,则系表明该反应已经达到化学平衡的该等量关系可以是v(H2)正=3v(N2)逆(其它答案正确同样得分) ;因为该反应是放热反应,说明反应物的总能量高于生成物的总能量,即:E反>E生。
考点:考查无机框图题推断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和抽象思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


科目:高中化学 来源: 题型:单选题
化学与生活密切相关,下列说法不正确的是
| A.在汽车排气管上加装“催化转化器”可以减少有害气体的排放 |
| B.“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 |
| C.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物",PM2.5在空气中有可能形成胶体 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)现有常见金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: 乙 、H 。
(2)写出反应③的离子方程式: 。
写出反应⑦的离子方程式: 。
B与C的最高价氧化物反应的化学方程式 。
(3)实验室检验物质G中阳离子的常用试剂是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
图中各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥,B、D常温常压下是气体。请回答下列问题: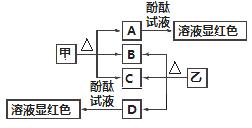
(1)甲的俗名是________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,其原理________(填“相同”或“不相同”)。
(3)甲在潮湿的空气中会缓慢分解,A会吸收空气中的水分:A+nH2O===A·nH2O(n为平均值,n≤10),取没有妥善保管的甲样品9.16 g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的B的体积(标准状况)如下表:(溶于水中的B不计)
| 盐酸的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| 生成B的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如右图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应B+A→C的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则反应 A+D→B的离子方程式为 。
(3)若A为强碱,D为气态酸性氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图b所示(不考虑D的溶解和水的挥发)。
①若图a符合事实,则D为 (填化学式),此时图a中x 7(填“>”“<”或“=”)
②若图b符合事实,且图b中y<7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。 |
| B元素原子的核外p电子数比s电子数少1。 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满。 |
| E元素的主族序数与周期数的差为4。 |
| F是前四周期中电负性最小的元素。 |
| G在周期表的第七列。 |


查看答案和解析>>
科目:高中化学 来源: 题型:推断题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)丁香酚氧基乙酸甲酯(E)在人类高血脂症的治疗方面有应用前景。其合成路线(部分反应条件略去)如下: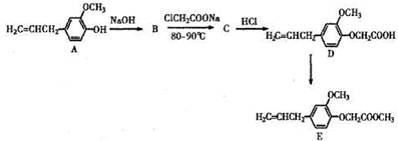
(1)B →C的反应类型是 ;B的结构简式是 。(2)D中含氧官能团的名称是醚基和 。
(3)请写出ClCH2COONa的酸化产物能同时满足下列条件的同分异构体结构简式
①能发生银镜反应 ②属于酯类
(4)由D合成E的化学方程式是 。
(5)下列关于A的说法正确的是 。
| A.1molA完全燃烧消耗12molO2 | B.能使酸性KMnO4溶液褪色 |
| C.能与NaHCO3反应 | D.既能与溴发生加成反应又能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com