
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。 |
| B元素原子的核外p电子数比s电子数少1。 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满。 |
| E元素的主族序数与周期数的差为4。 |
| F是前四周期中电负性最小的元素。 |
| G在周期表的第七列。 |


(1) 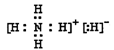 (2分) (2)3(2分) ,哑铃型(2分) (3)泡利原理(1分) (4)第VIIB(1分)
(2分) (2)3(2分) ,哑铃型(2分) (3)泡利原理(1分) (4)第VIIB(1分)
d(1分) ,3d54s2(1分) (5)sp3(1分) ,三角锥(1分) (6) (3分)
(3分)
解析试题分析:根据题目所给信息可知:A为H元素。B元素的核外电子排布为1s22s22p3。不可能为1s22s22p53s2。
所以B为N元素。根据C原子的第一至第四电离能的数据:可知C原子最外层2个电子易失去。结合题干
信息,主族元素,原子序数递增,可推知C为Mg元素。D原子核外所有p轨道全满或半满,可推知D的
核外电子排布为1s22s22p63s23p3或者为1s22s22p63s23p6,前面排布是P元素。后面是Ar元素(非主族元素)。E元素的主族序数与周期数的差为4,D是P元素,所以E只能在第三周期,所以为第VIIA族。E为Cl元素。F是前四周期中电负性最小的元素,电负性同周期从左到右逐渐增大,同主族从上到下逐渐减小。所以可推知F是K元素。G在周期表的第七列。所以为第VIIB族。为Mn元素。综上所述可推知各元素分别为:A是H,B是N,C是Mg,D是P,E是Cl,F是K,G是Mn。
(1)已知NH5为离子化合物,非金属离子化合物,显然应是铵盐,还有铵根离子,所以其电子式为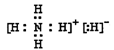 。
。
(2)N的核外电子排布为1s22s22p3,其基态原子中能量最高的电子应是p电子,其电子云在空间有3个伸展方向(x,y,z),原子轨道呈哑铃形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为: 
电子排布图中3s违背了泡利原理。同一轨道上不可能存在两个状态完全一样的电子。
(4)Mn价电子排布式为3d54s2,位于第VIIB族d区。
(5)PCl3分子中,根据VSEPR理论,价层电子对数目为4对,孤电子对数是1,所以中心原子的杂化方式为sp3,其分子的立体构型为三角锥。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,根据晶胞结构可推断出,一个晶胞单元中含有2个金属原子。设晶胞边长为bcm,则有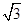 b=4r,根据ρ=
b=4r,根据ρ= ,则有(
,则有(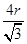 )3=
)3= 可推出r=
可推出r= 。
。
考点:物质结构中的相关概念:电子式的书写、电子排布图、排布式的书写、杂化形式的判断、立体构型、晶胞计算


科目:高中化学 来源: 题型:推断题
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:(已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀)该同学得出的结论正确的是
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示。其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G的焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一。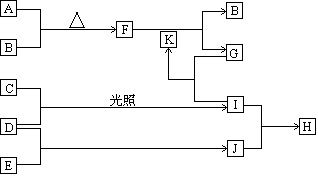
(1)写出五种单质的名称
(2)I、J相遇反应生成H,反应的现象是 ,化学反应方程式为 ,H物质的电子式为
(3)F的颜色为 ,F和K反应的化学方程式为 。
(4)G和H也可以发生反应,若G和H恰好完全反应,则A、B、C、D、E的物质的量之比为 。
(5)D和E的反应是典型的可逆反应,并且是放热反应。该反应的化学方程式为
请用某两种物质的反应速率间的等量关系表明该反应已经达到化学平衡,该等量关系可以是 ;反应物的总能量E反与生成物的总能量E生的大小关系是:E反 E生。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。F原子的一种核素的质量数为65,中子数为 36。请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个。
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如图,F为 球(“黑”“白”)
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: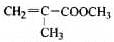
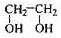
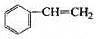

(甲) (乙) (丙) (丁)
填写下列空白:
(1)下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):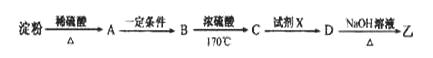
A的分子式是___________,试剂X可以是___________。
(4)已知: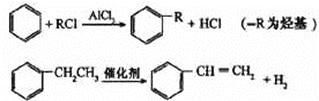
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(7分)(1)多羟基连在同一个碳原子上易自动失水生成醛或酮。请写出 NaOH的水溶液共热的化学方程式为 。
NaOH的水溶液共热的化学方程式为 。
(2)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为 ;
反应②的反应类型属于 。
(3)由对苯二甲醛(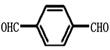 )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为 。
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com